题目内容
1.某有机物分子中含n1个-CH2-,n2个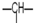 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
分析 有机物主要靠C原子连接,每个碳原子都必须形成4个共价键,以1条碳链分析考虑,先分析若只连接-OH,计算连接的-OH数目,再根据分子中含有的-OH数目计算-CH3数,1个 可连接1个-CH3,-CH2-不管多少个只能连接两个-CH3,据此计算判断.
可连接1个-CH3,-CH2-不管多少个只能连接两个-CH3,据此计算判断.
解答 解:若只连接-OH,-CH2-不管多少个只能连接两个-OH,n2个 ,能连接n2个-OH,所以n1个-CH2-,n2个
,能连接n2个-OH,所以n1个-CH2-,n2个 ,连接-OH共计n2+2个,由于分子中含有n3个-OH,所以连接的-CH3为n2+2-n3,故选C.
,连接-OH共计n2+2个,由于分子中含有n3个-OH,所以连接的-CH3为n2+2-n3,故选C.
点评 本题考查常见有机物结构,侧重考查学生知识迁移能力,采用补缺法分析解答即可,题目难度不大.

练习册系列答案
相关题目
12.下列关于碱金属的叙述中,正确的是( )
| A. | 碱金属中密度最小,熔、沸点最高的是铯 | |
| B. | 钠离子核外电子数比钠原子核外电子数少 | |
| C. | 碱金属单质都可保存在煤油中 | |
| D. | 金属钠着火时,可用水或泡沫灭火器灭火 |
9.下列说法或表示法不正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在热化学方程式中无论是反应物还是生成物必须表明聚集状态 |
16.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答):
(1)其中原子半径最小的是H元素,没有正化合价的是O、F元素.
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
6.反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了3mol,则此反应的平均反应速率v(H2O)为( )
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |
13.已知:(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s);△H=-348.3kJ•mol-1
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
| A. | -317.3 kJ•mol-1 | B. | -379.3 kJ•mol-1 | C. | +317.3 kJ•mol-1 | D. | +379.3 kJ•mol-1 |
3.用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
表中a、b的值分别为:a=50、b=10
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:加入最后一滴KMnO4溶液,溶液呈浅红色,且30秒内不褪色;
实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/L KMnO4溶液 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同, 进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).

 .
.