题目内容
17.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变为棕黄色,说明氯水中含有HClO | |
| C. | 向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色.
解答 解:溶液中存在平衡Cl2+H2O?HCl+HClO,
A.只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故A正确;
B.溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色,不能说明氯水中含有HClO,故B错误,
C.溶液与硝酸银反应产生白色沉淀,只能是氯离子与银离子反应得到AgCl白色沉淀,说明氯水中含有Cl-,故C正确;
D.溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,故D正确;
故选B.
点评 本题考查氯水的性质,难度不大,侧重对基础知识的考查,需要学生熟练掌握基础知识.

练习册系列答案
相关题目
7.从原子序数11依次增加到17,下列所叙递变关系错误的是( )
| A. | 电子层数逐渐增多 | B. | 原子核吸引电子的能力逐渐增强 | ||
| C. | 最高正价数值逐渐增大 | D. | 从硅到氯负价从-4到-1 |
8.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素原子的内层电子数是最外层电子数的一半,则下列说法不正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | Q的一种核素质量数是A,则其中子数是A-17 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | W简单阴离子失电子能力比Q简单阴离子强 | |
| D. | 由X元素组成的单质有多种,它们之间互称同素异形体 |
5.亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图.下列有关叙述正确的是( )
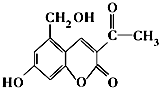

| A. | 亮菌甲素中含有四种官能团 | |
| B. | 亮菌甲素不能与NaHCO3溶液发生反应 | |
| C. | 1 mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2 mol NaOH | |
| D. | 每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
12.下列关于碱金属的叙述中,正确的是( )
| A. | 碱金属中密度最小,熔、沸点最高的是铯 | |
| B. | 钠离子核外电子数比钠原子核外电子数少 | |
| C. | 碱金属单质都可保存在煤油中 | |
| D. | 金属钠着火时,可用水或泡沫灭火器灭火 |
9.下列说法或表示法不正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在热化学方程式中无论是反应物还是生成物必须表明聚集状态 |
6.反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了3mol,则此反应的平均反应速率v(H2O)为( )
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |