题目内容
11.元素周期表是学习化学的重要工具,它隐含许多信息和规律.(1)用元素符号标出氧、钠、镁、铝、硫、氯在周期表中对应位置(以下为周期表的一部分)
(2)铝元素处于周期表中第三周期第IIIA族.
(3)上述六种元素的最高价氧化物对应的水化物酸性最强的是HClO4(填化学式).最高价氧化物对应的水化物碱性最强的是NaOH(填化学式)
(4)写出铝和氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)用电子式表示镁和氯气形成化合物的过程:
 .
.
分析 (1)根据原子电子层数、最外层电子数确定在周期表中的位置;
(2)铝原子核外有3个电子层、最外层有3个电子,主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
(4)铝与强碱溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁.
解答 解:(1)O元素位于第二周期第VIA族、Na元素位于第三周期第IA族、Mg元素位于第三周期第IIA族、Al元素位于第三周期第IIIA族、S元素位于第三周期第VIA族、Cl元素位于第三周期第VIIA族,所以其在周期表中的位置为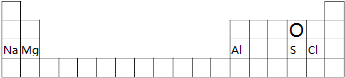 ,
,
故答案为: ;
;
(2)铝原子核外有3个电子层、最外层有3个电子,主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等,所以Al位于第三周期第IIIA族,故答案为:三;IIIA;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,除了O元素为,非金属性最强的元素是Cl元素,则酸性最强的酸是HClO4,最高价氧化物对应的水化物碱性最强的是金属性最强的钠形成的氢氧化钠,故答案为:HClO4;NaOH;
(4)铝与强碱溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,改成离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁,其形成过程为 ,
,
故答案为: .
.
点评 本题考查元素周期表和元素周期律的综合应用,涉及元素周期律知识、电子式、元素在周期表中的位置确定等知识点,熟悉元素周期表结构、原子结构即可解答,难点是用电子式表示物质形成过程.

| A. | NaOH | B. | ZnO | C. | Zn | D. | Fe2O3 |
| A. | 水 | B. | AgNO3溶液 | C. | 高锰酸钾 | D. | 溴水 |
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |
| A. | 甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种 | |
| C. | 含有5个碳原子的某饱和链烃,其一氯代物有3种 | |
| D. | 菲的结构为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
| A. | ①②③④ | B. | ①②⑦ | C. | ⑤⑥⑦ | D. | ③④⑤⑥ |
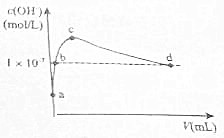 在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10m01•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7m01•L-1 | |
| C. | c点溶液中:c(K+)>c(HT-)>c(T2-) | |
| D. | d点溶液中:c(K+)=2c(T2-)+c(HT-) |
