题目内容
16.从碳骨架形状进行分类,关于下列各有机物的说法中正确的是( )①CH3CH2Cl②
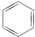 ③(CH3)2C=CH2④
③(CH3)2C=CH2④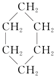 ⑤
⑤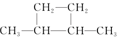
| A. | 链状烃:①③⑤ | B. | 链状烃:③⑤ | C. | 环状烃:②④⑤ | D. | 芳香烃:②④ |
分析 常见有机物的官能团为-Cl、碳碳双键,苯环不是官能团,含苯环的烃为芳香烃,②④⑤均具有环状结构,以此来解答.
解答 解:A.⑤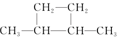 含环状结构,不是链状烃,故A不选;
含环状结构,不是链状烃,故A不选;
B..⑤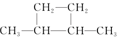 含环状结构,不是链状烃,故B不选;
含环状结构,不是链状烃,故B不选;
C.②④⑤均具有环状结构,均只含C、H元素,均为环状烃,故C选;
D.④ 中不是苯环,不是芳香烃,故D不选;
中不是苯环,不是芳香烃,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意环状烃与芳香烃的区别,题目难度不大.

练习册系列答案
相关题目
6.下列关于性质递变规律的叙述,正确的是( )
| A. | 还原性:Na>Mg>Ca | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H2SO4>H3PO4>HClO4 | D. | 稳定性:PH3>H2S>HCl |
7.从原子序数11依次增加到17,下列所叙递变关系错误的是( )
| A. | 电子层数逐渐增多 | B. | 原子核吸引电子的能力逐渐增强 | ||
| C. | 最高正价数值逐渐增大 | D. | 从硅到氯负价从-4到-1 |
4.已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,
(1)下面给出14种元素的电负性:
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐增大,同主族元素从上至下,电负性逐渐减小.
②预测元素电负性的大小关系:Br>I,电负性最小的元素在周期表中的位置是第6周期ⅠA族(放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所 需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量Li原子失去1个电子后形成稳定结构再失1个电子困难.
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar(均填元素符号).
(1)下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐增大,同主族元素从上至下,电负性逐渐减小.
②预测元素电负性的大小关系:Br>I,电负性最小的元素在周期表中的位置是第6周期ⅠA族(放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所 需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar(均填元素符号).
1.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4.在调节溶液pH值时,应选用的试剂是( )
| A. | NaOH | B. | ZnO | C. | Zn | D. | Fe2O3 |
8.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素原子的内层电子数是最外层电子数的一半,则下列说法不正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | Q的一种核素质量数是A,则其中子数是A-17 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | W简单阴离子失电子能力比Q简单阴离子强 | |
| D. | 由X元素组成的单质有多种,它们之间互称同素异形体 |
5.亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图.下列有关叙述正确的是( )
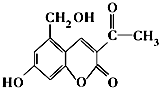

| A. | 亮菌甲素中含有四种官能团 | |
| B. | 亮菌甲素不能与NaHCO3溶液发生反应 | |
| C. | 1 mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2 mol NaOH | |
| D. | 每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
6.反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了3mol,则此反应的平均反应速率v(H2O)为( )
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |

 .
.