题目内容
7.铝和镁比较,金属性较强的是Mg(填元素符号),并举一实例说明此结论镁单质可以与氯化铝溶液发生置换反应生成铝单质.分析 Mg、Al均在第三周期,同周期从左向右金属性减弱,可以用活泼金属将不活泼金属从其盐溶液中置换从来,说明金属性强弱,由此分析解答.
解答 解:Mg、Al均在第三周期,同周期从左向右金属性减弱,所以金属性较强的是Mg; 镁单质可以与氯化铝溶液发生置换反应生成铝单质证明镁的金属性强于铝,故答案为:Mg;镁单质可以与氯化铝溶液发生置换反应生成铝单质.
点评 本题考查了元素周期律和氧化还原反应的规律,和元素金属性强弱判断依据,题目难度不大结合相应知识不难找到答案.

练习册系列答案
相关题目
17.下列离子方程式错误的是( )
| A. | CuO+2H+═Cu2++H2O | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | Fe+2H+═Fe2++H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
15.已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的$\frac{3}{5}$倍,下列叙述中正确的是( )
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所得电荷数SO42-是Na+的0.4倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
2.2000年前的《神农本草经》就有麻黄能“治咳逆上气”额记载,它的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 麻黄的分子式为C10 H17O | |
| B. | 麻黄可以从植物中提取 | |
| C. | 麻黄在空气中燃烧有NO释出 | |
| D. | 麻黄的一溴代物有3种且可与HCl反应 |
12.关于元素周期表的说法正确的是( )
| A. | 第三周期有8种元素 | |
| B. | 短周期元素是指第一、二周期所含有的全部元素 | |
| C. | 元素周期表有8个主族 | |
| D. | IA族中的元素全部是金属元素 |
19.下列不是离子化合物的是( )
| A. | HCl | B. | CaI2 | C. | KOH | D. | NaNO3 |
16.观察下列几个装置示意图,有关叙述不正确的是( )
| A. |  装置中阴极上析出红色固体 | |
| B. | 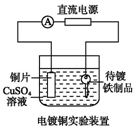 装置的待镀铁制品应与电源负极相连 | |
| C. | 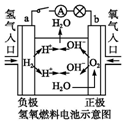 装置闭合电键后,外电路电子由a极流向b极 | |
| D. | 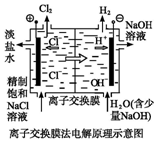 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
3.资料显示“强酸性或强碱性溶液可使品红溶液褪色”.某兴趣小组探究S02使品红溶液褪色的原因,实验如下.
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
(1)SO2水溶液中含$\stackrel{+4}{S}$的微粒有SO2、H2SO3、HSO3-、SO32-.
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:
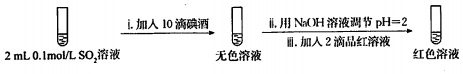
步骤二: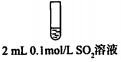
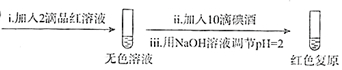
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:

步骤二:

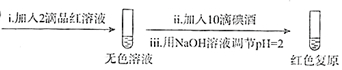
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).