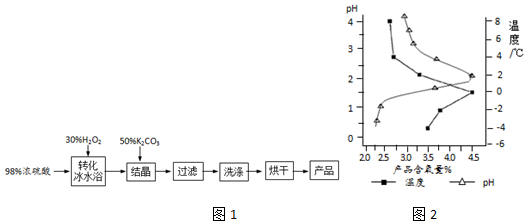
题目内容
15.下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的是( )| A. | 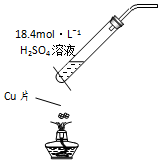 用图装置制取SO2 | |
| B. | 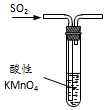 图装置中溶液的颜色变浅,说明SO2具有漂白性 | |
| C. | 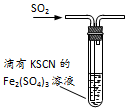 图装置中溶液的颜色变浅,说明SO2具有还原性 | |
| D. |  图装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性 |
分析 A.浓硫酸与铜在加热条件下反应生成二氧化硫气体;
B.二氧化硫与高锰酸钾发生发生氧化还原反应;
C.二氧化硫可被铁离子氧化;
D.二氧化硫和硫化氢发生氧化还原反应可生成硫.
解答 解:A.浓硫酸具有强氧化性,与铜在加热条件下反应生成二氧化硫气体,可用于制备少量二氧化硫,故A正确;
B.二氧化硫具有还原性,与高锰酸钾发生发生氧化还原反应,故B错误;
C.溶液的颜色变浅,说明铁离子被还原,可说明二氧化硫具有还原性,被铁离子氧化,故C正确;
D.二氧化硫中S元素的化合价为+4价,处于中间价态,具有氧化性,二氧化硫和硫化氢发生氧化还原反应可生成硫,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象、实验结论为解答的关键,侧重分析与实验能力的考查,注意把握二氧化硫的性质,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
19.下列不是离子化合物的是( )
| A. | HCl | B. | CaI2 | C. | KOH | D. | NaNO3 |
6.在浓盐酸中HNO2与SnCl2反应的离子方程式为3SnCl2+12Cl-+2HNO2+6H+═N2+3SnClxy-+4H2O,关于该反应的说法都正确的是( )
①氧化剂是HNO2;②还原性:Cl->N2;③每生成2.8gN2,还原剂失去的电子为0.6mol;④x为6,y为2;⑤SnClx-是氧化产物.
①氧化剂是HNO2;②还原性:Cl->N2;③每生成2.8gN2,还原剂失去的电子为0.6mol;④x为6,y为2;⑤SnClx-是氧化产物.
| A. | ①③ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
3.资料显示“强酸性或强碱性溶液可使品红溶液褪色”.某兴趣小组探究S02使品红溶液褪色的原因,实验如下.
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
(1)SO2水溶液中含$\stackrel{+4}{S}$的微粒有SO2、H2SO3、HSO3-、SO32-.
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:
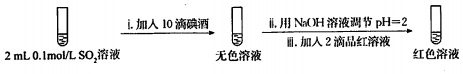
步骤二: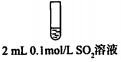
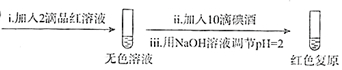
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
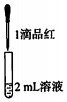 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:

步骤二:

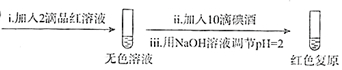
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
10.下列说法正确的是( )
| A. | 铅蓄电池工作时,电解质溶液H2SO4的浓度不变 | |
| B. | 加水稀释0.1 mol•L-1CH3COOH溶液时,CH3COOH的电离程度增大,pH减小 | |
| C. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4×6.02×1023个 |
7.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,11.2L C2H6中含有共价键的数目为3.5NA | |
| B. | 通常状况下,2.0 g H2 和1 mol Cl2反应后的气体分子数目为2NA | |
| C. | 1molAl分别与足量的盐酸、足量的NaOH溶液反应,转移的电子数都是3NA | |
| D. | 将3.4g H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
4.下列关系中正确的是( )
| A. | 将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr | |
| B. | 常温下,浓度为0.1mol•L-1的HA溶液(Ka=10-5)pH≈3 | |
| C. | c(SO32-)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3) | |
| D. | 25℃时,向10mL0.01mol•L-1KOH溶液中滴加10mL0.01mol•L-1的醋酸溶液后,混合液中:c(K+)>c(CH3COO-)>c(OH-)=c(H+) |
12.NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 由12C、16O、14N组成的44gCO2和44gN2O中含有的中子数均为22NA | |
| B. | 2L 0.5mol/L亚硫氢硫酸钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl时转移的电子数等于0.2NA | |
| D. | 适当条件下2molSO2与2molO2充分反应,反应体系中最终的气体分子数为3NA |