题目内容
8.下列关于有机化合物的说法正确的是( )| A. | 油脂的皂化反应可得到高级脂肪酸与甘油 | |
| B. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 | |
| C. | 可以淀粉为原料制取乙酸乙酯 | |
| D. | 油脂的皂化反应属于加成反应 |
分析 A、油脂在碱性条件下的水解反应称为造化反应;
B、油脂在酸性条件下水解为高级脂肪酸和甘油,在碱性条件下水解为高级脂肪酸盐和甘油;
C、淀粉能水解为葡萄糖,而葡萄糖在酒化酶的作用下能反应生成乙醇,据此分析制取乙酸乙酯的方法;
D、油脂在碱性条件下的水解反应称为造化反应.
解答 解:A、油脂在碱性条件下的水解反应称为造化反应,故得到的产物是高级脂肪酸盐和甘油,故A错误;
B、油脂在酸性条件下水解为高级脂肪酸和甘油,在碱性条件下水解为高级脂肪酸盐和甘油,故油脂在酸性或碱性条件下均能水解,但产物不同,故B错误;
C、淀粉能水解为葡萄糖,而葡萄糖在酒化酶的作用下能反应生成乙醇,乙醇经催化氧化可得乙醛,而乙醛氧化可得乙酸,乙醇和乙酸经酯化反应可得乙酸乙酯,故C正确;
D、油脂在碱性条件下的水解反应称为造化反应,故油脂的造化反应属于水解反应,不是加成反应,故D错误.
故选C.
点评 本题考查了油脂在酸性条件下和碱性条件下的水解,应注意的是只有油脂在碱性条件下的水解反应才称为造化反应.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
12.关于元素周期表的说法正确的是( )
| A. | 第三周期有8种元素 | |
| B. | 短周期元素是指第一、二周期所含有的全部元素 | |
| C. | 元素周期表有8个主族 | |
| D. | IA族中的元素全部是金属元素 |
13.下列说法正确的是( )
| A. | 乙酸乙酯中是否混有乙酸,可以加石蕊试液进行检测 | |
| B. | 乙醇中是否混有乙酸,可以加入金属钠进行检验 | |
| C. | 乙酸乙酯、乙酸均能与NaOH反应,二者分子中的官能团相同 | |
| D. | 淀粉和蛋白质均可水解生成葡萄糖 |
16.在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)?2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L•min).下列说法不正确的是( )
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)?2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L•min).下列说法不正确的是( )
| A. | 反应4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2 | |
| B. | 平衡后c(Cl2)=2.5×10-2mol/L | |
| C. | 其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
3.资料显示“强酸性或强碱性溶液可使品红溶液褪色”.某兴趣小组探究S02使品红溶液褪色的原因,实验如下.
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
(1)SO2水溶液中含$\stackrel{+4}{S}$的微粒有SO2、H2SO3、HSO3-、SO32-.
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
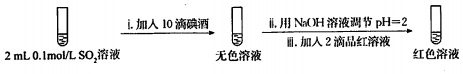
步骤一:
步骤二: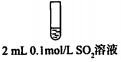
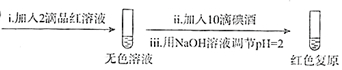
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:

步骤二:

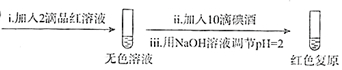
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
13.物质的性质决定其用途.下列说法正确的是( )
| A. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| B. | 氯化铝是强电解质,可电解其水溶液获得金属铝 | |
| C. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
17.生产、生活中处处有化学,下列有关说法正确的是( )
| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,pH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 药皂中含有的苯酚具有强氧化性,能杀菌消毒 | |
| D. | 胶体具有介稳性的主要原因是因胶体粒子所作的布朗运动使它们不容易聚集成质量较大的颗粒而沉降下来 |
5.下列物质的性质与氢键无关的是( )
| A. | 乙醚的沸点 | B. | 乙醇在水中的溶解度 | ||
| C. | 氨气极易溶于水 | D. | 甲醇的熔点 |