题目内容
17.A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO${\;}_{3}^{-}$、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克.常温下各烧杯中溶液的pH与电解时间t的关系如图所示.据此回答下列问题: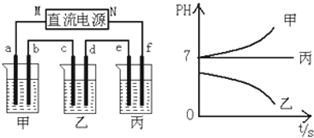
(1)M为电源的负极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为NaCl、AgNO3(填写化学式).
(2)计算电极f上生成的气体在标准状况下体积为0.56L.
(3)写出乙烧杯中的电解反应方程式:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为10L,则该溶液的pH为12.
分析 根据乙中C电极质量增加了10.8克,说明c电极是阴极,连接c电极的电源M电极为负极;c电极上质量增加,析出金属单质,所以乙装置中含有银离子,又电解乙装置中电解质溶液,溶液的pH值减小,所以阳极上析出氢氧根离子,结合离子的共存可知乙电解质溶液是AgNO3溶液;电解时,甲装置中溶液的pH值增大,说明阴极上氢离子放电,阳极上放电能力比氢氧根离子强的离子放电,甲装置电解质溶液是NaCl溶液,则丙为硫酸钠溶液,结合电极方程式解答该题.
解答 解:根据乙中C电极质量增加了10.8克,说明c电极是阴极,连接c电极的电源M电极为负极;c电极上质量增加,析出金属单质,所以乙装置中含有银离子,又电解乙装置中电解质溶液,溶液的pH值减小,所以阳极上析出氢氧根离子,结合离子的共存可知乙电解质溶液是AgNO3溶液;电解时,甲装置中溶液的pH值增大,说明阴极上氢离子放电,阳极上放电能力比氢氧根离子强的离子放电,甲装置电解质溶液是NaCl溶液,则丙为硫酸钠溶液,
(1)由以上分析可知M为负极,甲为氯化钠溶液,乙为硝酸银溶液,故答案为:负;NaCl;AgNO3;
(2)乙烧杯中c电极发生Ag+e-=Ag,质量增加了10.8克,则n(Ag)=$\frac{10.8g}{108g/mol}$=0.1mol,可知转移电子0.1mol,电极f为阳极,发生4OH--4e-=2H2O+O2,可知生成0.025mol阳极,体积为0.025mol×22.4L/mol=0.56L,
故答案为:0.56L;
(3)乙烧杯中阳极上氢氧根离子放电、阴极上银离子放电,所以电池反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
(4)电解甲溶液的电极反应式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,当转移电子0.1mol,生成氢氧化钠的物质的量是0.1mol,所以氢氧化钠的浓度是:$\frac{0.1mol}{10L}$=0.01mol/L,所以溶液的pH=12,故答案为:12.
点评 本题考查了电解原理,为高频考点,侧重于学生的分析、计算能力的考查,明确离子放电顺序是解本题关键,会根据电解过程中pH变化确定电解质,再结合转移电子守恒进行计算,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 离子化合物中一定含有离子键 | |
| B. | 常温呈气态的单质分子中均存在共价键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA | |
| C. | NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA | |
| D. | 1 mol Fe在氧气中充分燃烧失去3NA个电子 |
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.
(1)该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3;
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3].
(2)为了确定产物,进行以下定性实验:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为氢气 |
| 实验Ⅲ | 将实验Ⅰ中的白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适量CaCl2或BaCl2稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO${\;}_{3}^{2-}$ |
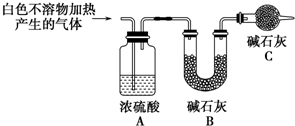
称取干燥、纯净的白色不溶物4.52g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验后装置A增重0.36g,装置B增重1.76g.
装置C的作用是防止空气中的水蒸气和CO2进入装置B中,影响实验结果;白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式:3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
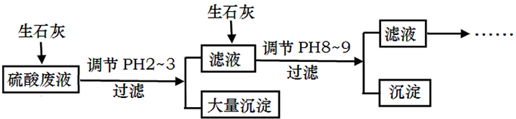
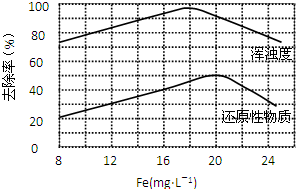 FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
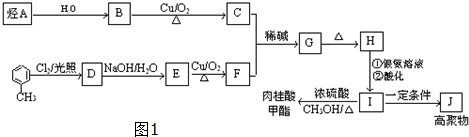
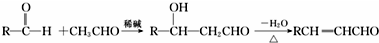
 $→_{△}^{硫酸}$
$→_{△}^{硫酸}$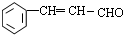 +H2O.
+H2O.