题目内容
7. 磷单质及其化合物的有广泛应用.
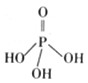
磷单质及其化合物的有广泛应用.(1)三聚磷酸可视为三个磷酸分子(磷酸结构式见图)之间脱去两个分子产物,其结构式为
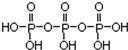 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10(2)次磷酸钠(NaH2PO2)可用于化学镀镍.
①NaH2PO2中P元素的化合价为+1.
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)2Ni2++1H2PO2-+1H2O→2Ni++1H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3-+3H2↑
分析 (1)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,即磷酸分子间两个羟基脱去应该水分子;三聚磷酸钠可以看作三聚磷酸中五个羟基的氢原子换成钠离子;
(2)①由化合价代数为零可求算化合物中P元素的化合价;
②镍元素的化合价降低了1价,磷元素的化合价升高的2价,化合价升降最小公倍数为2,故Ni2+的系数均为2,H2PO3-的系数为1,根据电荷守恒可知生成物中缺项为H+,再根据原子守恒、电荷守恒配平.
解答 解:(1)磷酸分子间通过羟基脱水形成三聚磷酸,所以三聚磷酸的结构式为: ;三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠(俗称“五钠”),所以三聚磷酸钠的化学式为:Na5P3O10,
;三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠(俗称“五钠”),所以三聚磷酸钠的化学式为:Na5P3O10,
故答案为: ; Na5P3O10;
; Na5P3O10;
(2)①由化合价代数为零,H为+1,Na为+1,O为-2,故可求算化合物中P元素的化合价为+1价,故答案为:+1;
②(a)镍元素的化合价降低了1价,磷元素的化合价升高的2价,故Ni2+的系数均为2、H2PO2-的系数均为1,根据电荷守恒可知生成物中缺项为H+,根据原子守恒、电荷守恒可得配平的方程式为:2Ni2++H2PO2-+H2O═2Ni+H2PO3-+2H+,
故答案为:2;1;1H2O;2;1;2H+.
点评 本题考查物质结构式的,化合价的确定,氧化还原反应配平,属于拼合型题目,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 稀硫酸:Fe2+、Cl-、NO3-、K+ | B. | 澄清溶液:MnO4-、S2-、Na+、H+ | ||
| C. | 食盐水:K+、NO3-、SO42-、Mg2+ | D. | pH=7的溶液:Na+、HCO3-、SO42-、K+ |
18.下列说法正确的是( )
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度稳定后记下温度 |
15.相同状况下,等质量的O2和CO2相比较,下列叙述正确的是( )
| A. | 体积比为8:11 | B. | 密度之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
2.0.2mol 气态燃料B2H6在氧气中燃烧,生成固态三氧化二硼和气态水,放出406.6kJ的热量,又知:H2O (l )═H2O(g)△H=+44kJ•mol-1,则B2H6的燃烧热为( )
| A. | 2165 kJ•mol-1 | B. | 2033 kJ•mol-1 | C. | 406.6 kJ•mol-1 | D. | 2077 kJ•mol-1 |
12.下列有关实验原理、装置、操作或结论的描述,不正确的是(有关装置的夹持仪器略去未画)( )
| A. | 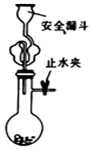 实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 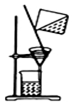 提纯氢氧化铁胶体 | D. |  实验室用乙醇和硫酸制已烯 |
19.常温、常压下,容器内有aLH2S和bLSO2,充分反应后混合气体体积缩小至原来的一半,则a:b可能是
( )
( )
| A. | 1:2 | B. | 2:1 | C. | 5:1 |
17.根据元素在周期表中的位置判断,下列元素中原子半径最小的是( )
| A. | 钾 | B. | 镁 | C. | 硅 | D. | 氯 |