题目内容
12.下列有关实验原理、装置、操作或结论的描述,不正确的是(有关装置的夹持仪器略去未画)( )| A. | 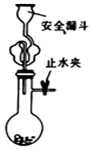 实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 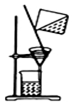 提纯氢氧化铁胶体 | D. | 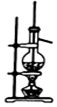 实验室用乙醇和硫酸制已烯 |
分析 A.碳酸钙与盐酸反应生成二氧化碳;
B.Cu与浓硫酸反应生成二氧化硫,二氧化硫能使品红褪色;
C.胶体可透过滤纸;
D.乙醇和浓硫酸加热到170℃时生成乙烯.
解答 解:A.盐酸可与大理石反应制备二氧化碳气体,用安全漏斗,可防止气体逸出、液体飞溅等,故A正确;
B.浓硫酸与铜反应可生成二氧化硫,二氧化硫具有漂白性,可用品红检验,故B正确;
C.胶体可透过滤纸,不能用过滤的方法,可用渗析的方法分离,故C错误;
D.实验室可用乙醇在浓硫酸作用下加热到170℃制备乙烯,图示装置可达到实验目的,故D正确;
故选C.
点评 本题考查化学实验方案的评价,涉及气体的制备、性质的检验、物质的分离等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的严密性和合理性,难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
3.某无色溶液中,可大量共存的离子组是( )
| A. | Na+、HCO3-、SO42-、Cl- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、K+、CO32- | D. | K+、Mg2+、SO42-、OH- |
1.将纯锌片和纯铜片按如图所方式插入同浓度的稀硫酸中,一段时间后,以下叙述正确的是( )

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中化学能转化成了电能 | ||
| C. | 甲中铜片是负极 | D. | 乙中铜片是正极 |
2.微粒用${\;}_{Z}^{A}$Rn+表示,下列关于该微粒的叙述正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A+Z |
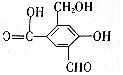 ,试回答下列问题:
,试回答下列问题: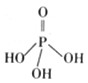 磷单质及其化合物的有广泛应用.
磷单质及其化合物的有广泛应用.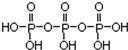 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10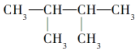 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;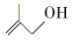 的分子式为C4H8O;
的分子式为C4H8O;