题目内容
19.常温、常压下,容器内有aLH2S和bLSO2,充分反应后混合气体体积缩小至原来的一半,则a:b可能是( )
| A. | 1:2 | B. | 2:1 | C. | 5:1 |
分析 混合发生反应2H2S+SO2=3S↓+2H2O,根据差量法计算参加反应的H2S、SO2的体积,剩余的气体可能是H2S或SO2,据此讨论计算.
解答 解:常温常压下容器内混有a L H2S和b L SO2,充分反应后混合气体体积缩小至原来的一半,故反应后气体的体积为0.5(a+b)L,故气体体积减少为(a+b)L-0.5(a+b)L=0.5(a+b)L,则:
2H2S+SO2=3S↓+2H2O 气体体积减少△V
2 1 3
V(H2S) V(SO2) 0.5(a+b)L
故V(H2S)=$\frac{1}{3}$(a+b)L,V(SO2)=$\frac{1}{6}$(a+b)L
若剩余气体为H2S,则SO2完全反应,故$\frac{1}{6}$(a+b)L=bL,整理得a:b=5:1;
若剩余气体为SO2,则H2S完全反应,故$\frac{1}{3}$(a+b)L=bL,整理得a:b=2:1;
故选BC.
点评 本题考查混合物的有关计算,难度中等,注意差量法与讨论法的利用.

练习册系列答案
相关题目
3.下列关于有机化合物的说法正确的是( )
| A. | 戊烷有4种同分异构体 | |
| B. | 乙酸和溴乙烷均可发生加成反应 | |
| C. | 乙烷和乙烯可用酸性KMnO4溶液鉴别 | |
| D. | 皂化反应的产物是高级脂肪酸和甘油 |
10.VmL密度为ρg/mL的某溶液,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为w%,物质的量浓度为cmol/L那么下列关系式正确的是( )
| A. | m=$\frac{{v}_{ρ}w}{1000}$ | B. | c=$\frac{(100{0}_{ρ}w)}{M}$ | C. | W%=[$\frac{cM}{1{0}_{ρ}}$]% | D. | C=$\frac{m}{VM}$ |
14.用NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标况下,11.2L CO和N2混合气体中含有的原子数是NA | |
| B. | 100g 98%的浓硫酸中,氧原子总数为4NA | |
| C. | 1 mol•L-1的NaClO溶液中含有ClO-的数目小于NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
11.将铝粉与某铁的氧化物FeO-2Fe2O3粉末配制成铝热剂,分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为3.92L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为( )
| A. | 2.8L | B. | 3.92L | C. | 5.60L | D. | 7.84L |
9.下列图示与对应的叙述不相符的是( )
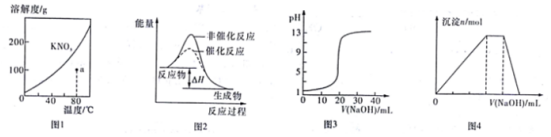

| A. | 图1表示KNO3的溶液曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别有无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. | 图4表示向NH4Al(SO4)2溶液中逐滴滴加NaOH溶液,随着NaOH溶液体积V的变化,沉淀总物质的量n的变化 |
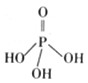 磷单质及其化合物的有广泛应用.
磷单质及其化合物的有广泛应用.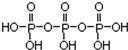 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10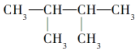 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;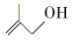 的分子式为C4H8O;
的分子式为C4H8O;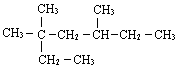 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基1-丁烯
2,3-二甲基1-丁烯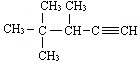 的系统名称为3,4,4-三甲基-1-戊炔
的系统名称为3,4,4-三甲基-1-戊炔 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.