题目内容
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 稀硫酸:Fe2+、Cl-、NO3-、K+ | B. | 澄清溶液:MnO4-、S2-、Na+、H+ | ||
| C. | 食盐水:K+、NO3-、SO42-、Mg2+ | D. | pH=7的溶液:Na+、HCO3-、SO42-、K+ |
分析 A.酸性条件下,离子之间发生氧化还原反应;
B.高锰酸钾具有强氧化性,可氧化硫离子;
C.离子之间不发生任何反应;
D.HCO3-水解呈碱性.
解答 解:A.酸性条件下,Fe2+、NO3-之间发生氧化还原反应,不能大量共存,故A错误;
B.MnO4-、S2-之间发生氧化还原反应,不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.HCO3-水解呈碱性,不能存在于中性溶液中,故D错误.
故选C.
点评 本题考查了离子共存,为高考常见题型,题目难度中等,明确离子反应发生条件为解答关键,注意掌握题干暗含条件的含义,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.现有结构式为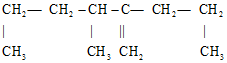 有机物,其正确命名应是( )
有机物,其正确命名应是( )
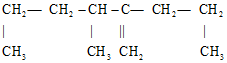 有机物,其正确命名应是( )
有机物,其正确命名应是( )| A. | 2,3-二丙基-1-丁烯 | B. | 2-丙基-3,5-二甲基-1-戊烯 | ||
| C. | 3-甲基-2-丙基-1-己烯 | D. | 3,5-二甲基-2-丙基-1-戊烯 |
2.向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量的氨气:NH4+、SO42-、Na+、AlO2- | |
| B. | 加入过量NaHCO3溶液:SO42-、Na+、Al3+、HCO3-、Fe2+ | |
| C. | 加入过量氯水:Cl-、SO42-、Fe3+、Al3+ | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+、Na+ |
6.一种新储能电池如图所示.下列说法正确的是( )
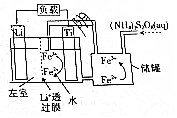

| A. | 左室电解质溶液为含Li+的水溶液 | |
| B. | 放电时,储罐中发生的离子反应为2Fe3++2SO42-═S2O82-+2Fe2+ | |
| C. | 充电时,钛极与外电源的负极相连 | |
| D. | 充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+ |
3.下列关于有机化合物的说法正确的是( )
| A. | 戊烷有4种同分异构体 | |
| B. | 乙酸和溴乙烷均可发生加成反应 | |
| C. | 乙烷和乙烯可用酸性KMnO4溶液鉴别 | |
| D. | 皂化反应的产物是高级脂肪酸和甘油 |
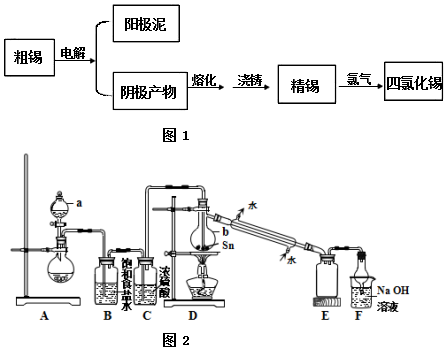
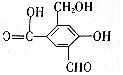 ,试回答下列问题:
,试回答下列问题: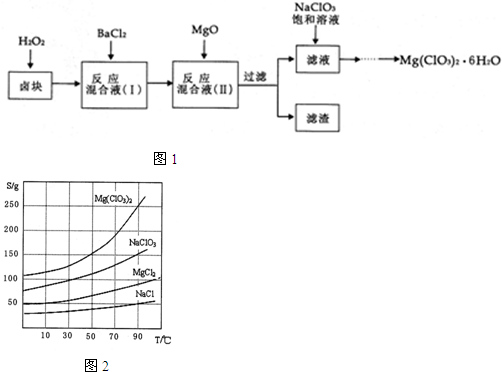
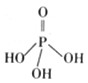 磷单质及其化合物的有广泛应用.
磷单质及其化合物的有广泛应用.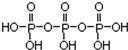 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10