题目内容
1.X、Y、Z、W、R五种短周期元素,原子序数依次增大.X原子是所有原子中半径最小的,Y、R同主族,Z、W、R 同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其原子的电子层数等于主族叙述,W单质是一种常见的半导体材料.下列税法正确的是( )| A. | R的气态氢化物比W的气态氢化物更稳定 | |
| B. | Z的氧化物能与盐酸反应,不能与NaOH溶液反应 | |
| C. | 原子半径按X、R、W、Z、Y的顺序依次增大 | |
| D. | X、Y、Z的最高化合价数值均等于其主族序数 |
分析 X、Y、Z、W、R五种短周期元素,原子序数依次增大,X原子是所有原子中半径最小的,则X为H元素;Y原子的最外层电子数是次外层的3倍,则Y有2个电子层,最外层电子数为6,故Y为O元素,Y、R同主族,故R为S元素;Z、W、R同周期,都处于第三周期,Z是常见的金属,其电子层数等于主族序数,则Z为Al元素;W单质是一种常见的半导体材料,则W为Si元素,据此进行解答.
解答 解:X、Y、Z、W、R五种短周期元素,原子序数依次增大,X原子是所有原子中半径最小的,则X为H元素;Y原子的最外层电子数是次外层的3倍,则Y有2个电子层,最外层电子数为6,故Y为O元素,Y、R同主族,故R为S元素;Z、W、R同周期,都处于第三周期,Z是常见的金属,其电子层数等于主族序数,则Z为Al元素;W单质是一种常见的半导体材料,则W为Si元素,
A.非金属性越强,对应气态氢化物越稳定,非金属性S(R)>Si(W),则R的气态氢化物比W的气态氢化物更稳定,故A正确;
B.Z为Al元素,其氧化物为氧化铝,氧化铝为两性氧化物,能够与盐酸和氢氧化钠溶液反应,故B错误;
C.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径按X、Y、R、W、Z的顺序依次增大,故C错误;
D.Y为O元素,氧元素没有最高化合价,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
11.下列气体通入少量的品红溶液中,能使溶液褪色的是( )
| A. | C02 | B. | S02 | C. | N2 | D. | HC1 |
16.下列各组物质在溶液中不发生化学反应而能共存的是( )
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
6.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )
| A. | 阴离子的还原性:Y>X | |
| B. | Y和Z的简单阴离子都会破坏水的电离平衡 | |
| C. | 最高价氧化物的水化物的酸性:Z>Y | |
| D. | 氢化物的热稳定性:W>X |
10.在含有大量H+、Fe3+、SO42-的溶液中,还能大量存在的离子是( )
| A. | CO32- | B. | Ba2+ | C. | SCN- | D. | NH4+ |
11.下列反应中,属于加成反应的是( )
| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 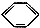 +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$ Br+HBr Br+HBr | |
| D. | CH2═CH2+Br2→CH2Br-CH2Br |