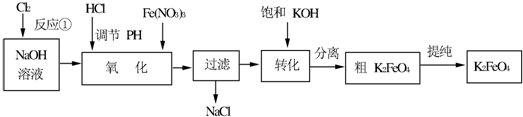
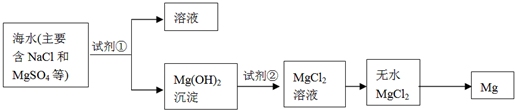
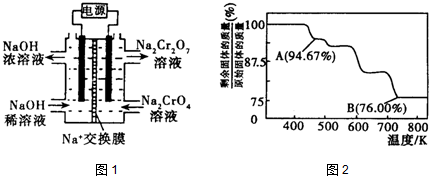
题目内容
4.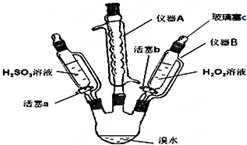 为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:
为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:(1)仪器A的名称球形冷凝管,其作用是冷凝回流溴,以免溴挥发.
(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是滴液漏斗和三颈瓶相通,气压相等.
(3)实验记录如下(请补全空白):
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 橙黄色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
步骤Ⅰ中反应的离子方程式H2SO3+Br2+H2O=4H++SO42-+2Br-,
步骤Ⅱ中主要反应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
分析 (1)由A的结构特征可知为球形冷凝管,溴易挥发,冷凝回流溴;
(2)滴液漏斗和三颈瓶相通,气压相等;
(3)Ⅰ:打开活塞a,逐滴加入H2SO3溶液至过量,H2SO3被溴水氧化;
Ⅱ:向步骤Ⅰ所得溶液中逐滴加入H2O2溶液,溶液又变为橙黄色,说明过氧化氢将溴离子氧化为溴单质;
(4)步骤Ⅱ中,开始时颜色无明显变化,可能是因为步骤1的H2SO3有过量,H2O2先和H2SO3反应,或H2O2浓度小或Br-与H2O2反应慢等.
解答 解:(1)仪器A的名称是球形冷你管,其作用是使溴蒸汽冷凝回流,
故答案为:球形冷凝管;冷凝回流溴,以免溴挥发;
(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是该仪器与三颈瓶相通,气压相等,液体能顺利流出,
故答案为:滴液漏斗和三颈瓶相通,气压相等;
(3)Ⅰ:打开活塞a,逐滴加入H2SO3溶液至过量,H2SO3被溴水氧化,溶液的橙黄色褪去,说明溴单质的氧化性强于亚硫酸;
Ⅱ:向步骤Ⅰ所得溶液中逐滴加入H2O2溶液,溶液又变为橙黄色,说明过氧化氢将溴离子氧化为溴单质,则H2O2的氧化性大于Br2,
故答案为:
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 橙黄色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
(4)步骤Ⅱ中,开始时颜色无明显变化可能是因为:步骤1的H2SO3有过量,H2O2先和H2SO3反应,或H2O2浓度小或Br-与H2O2反应慢等;
步骤Ⅰ中,亚硫酸与溴单质反应离子方程式为:H2SO3+Br2+H2O=4H++SO42-+2Br-,步骤Ⅱ中主要发生过氧化氢和溴离子的反应,离子方程式为:H2O2+2Br-+2H+=Br2+2H2O,
故答案为:步骤1的H2SO3有过量,H2O2先和H2SO3反应;H2SO3+Br2+H2O=4H++SO42-+2Br-;H2O2+2Br-+2H+=Br2+2H2O.
点评 本题考查物质性质探究实验,涉及到元素化合物性质、对装置与原理的分析评价、离子方程式书写、氧化还原反应等,关键是对实验原理的理解,难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
14.在溶液中能大量共存的离子组是( )
| A. | Na+、OH-、HCO3- | B. | Ag+、Fe3+、Cl- | C. | NH4+、K+、OH- | D. | Ba2+、OH-、Cl- |
15.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一.回答下列问题:
(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母代号).

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如下表所示
(前6min没有改变条件):
①X=0.14,250℃时该反应的平衡常数K=46.3.
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸.在常温下,甲酸的K=1×10-4,20.00mL 0.1000mol/L NaOH溶液与一定量等浓度甲酸溶液混合后所得溶液的c(HCOOH)=c(HCOO-),该溶液pH=4,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母代号).

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如下表所示
(前6min没有改变条件):
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸.在常温下,甲酸的K=1×10-4,20.00mL 0.1000mol/L NaOH溶液与一定量等浓度甲酸溶液混合后所得溶液的c(HCOOH)=c(HCOO-),该溶液pH=4,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
19.NA表示阿伏伽德罗常数,1molNaOH固体含有( )
| A. | NA个OH- | B. | 3NA个离子 | C. | 2NA原子 | D. | 10NA个电子 |
16.下列各组物质在溶液中不发生化学反应而能共存的是( )
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
14.下列说法正确的是( )
| A. | 已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 | |
| B. | 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O?H++OH-逆向移动,c(H+)降低 | |
| C. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入 0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| D. | 常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12 |