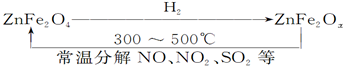题目内容
14.高铁电池是一种可逆电池,该电池能长时间保持稳定的放电电压.高铁电池总反应为3Zn+2K2Fe04+8H20?3Zn(OH)2+2Fe(OH)3+4KOH.下列判断不正确的是( )| A. | 放电时,负极反应为2n-2e-+20H一═Zn(OH)2 | |
| B. | 充电时,阴极pH增大 | |
| C. | 放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 | |
| D. | 充电时,阳极反应为Fe(OH)3+50H一+3e一=Fe042-+4H20 |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱.
解答 解:A、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B、充电时阴极发生Zn(OH)2得电子的还原反应,即反应为:Zn(OH)2+2e-=Zn+2OH-,所以阴极pH增大,故B正确;
C、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,每转移6mol电子,正极有6molOH-移向负极,和电极反应中电子转移、产生的氢氧根离子之间无关系,故C错误;
D、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-$\frac{\underline{\;充电\;}}{\;}$FeO42-+4H2O,故D正确.
故选C.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
4.常温下,下列事实能说明亚硝酸是弱电解质的是( )
| A. | NaNO2溶液的pH大于7 | B. | 用HNO2溶液作导电试验,灯泡很暗 | ||
| C. | HNO2不跟NaCl反应 | D. | 可以使石蕊试剂变色 |
2.A、B、C、D、E五种短周期元素,其原子序数逐渐增大.元素A的单质是密度最小的气体,元素B的单质存在两种以上同素异形体,且其中一种是自然界中硬度最大的单质,元素D的最外层电子数是次外层电子数的三倍.B、C、D、E四种元素均能与A形成电子数相等的四种分子,且化合物中各原子的个数比如下表:
下列说法正确的是( )
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 原子个数比 | B:A=1:3 | C:A=1:2 | D:A=1:1 | E:A=1:1 |
| A. | 元素E在元素周期表中的位置为第二周期第ⅦA族 | |
| B. | 原子半径:A<B<C<D | |
| C. | A、C、E中三种元素或任意两种元素形成的物质中只可能含有共价键 | |
| D. | A、B、C、D四元素中的三种能形成多种与甲分子电子数相等的化合物 |
9.在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化.下列有关说法正确的是( )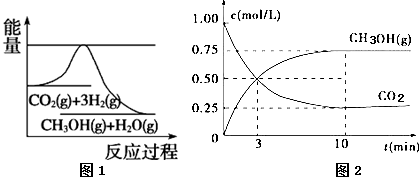
图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化.下列有关说法正确的是( )

| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则$\frac{n({CH}_{3}OH)}{n({CO}_{2})}$增大 | |
| C. | 温度降低,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数K增大 | |
| D. | 从反应开始到平衡,用氢气表示的平均反应速率为0.225 mol/(L•min) |
6.肉制品加工中,使用护色剂--亚硝酸钠必须严格控制用量,确保食品安全.某一反应体系共有反应物和生成物六种物质:NaNO2、H2O、NO、I2、NaI、HI.已知该反应中NaNO2只发生了如下过程:NaNO2→NO.下列有关说法不正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:2 | |
| B. | 若有1mol电子转移,则氧化产物的物质的量是0.5mol | |
| C. | 据此反应原理,可以在酸性条件下用淀粉碘化钾试纸检验NO${\;}_{2}^{-}$的存在 | |
| D. | 若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒 |