题目内容
9.在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化.下列有关说法正确的是( )
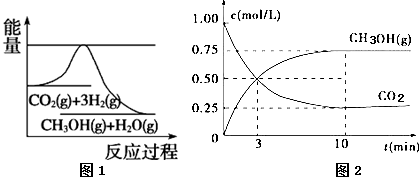
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则$\frac{n({CH}_{3}OH)}{n({CO}_{2})}$增大 | |
| C. | 温度降低,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数K增大 | |
| D. | 从反应开始到平衡,用氢气表示的平均反应速率为0.225 mol/(L•min) |
分析 A、反应物的总能量大于生成物的总能量时,反应放热;气体分子数减少的反应为熵减的反应,根据△G=△H-T△S判断;
B、再加入一定量CO2,平衡右移,以二氧化碳的量增加为主;
C、此反应为放热反应,逆反应是吸热反应,降低温度,平衡左移;
D、根据反应速率V=$\frac{△C}{△t}$和反应速率之比等于计量数之比来计算.
解答 解:A、反应物的总能量大于生成物的总能量时,反应放热,即△H<0;正反应方向的气体分子数减少,气体分子数减少的反应为熵减的反应,即△S<0,所以在低温下能自发,故A错误;
B、再加入一定量CO2,平衡右移,以二氧化碳的量增加为主,则$\frac{n({CH}_{3}OH)}{n({CO}_{2})}$减小,故B错误;
C、此反应为放热反应,逆反应是吸热反应,降低温度,平衡左移,K减小,故C错误;
D、从反应开始到平衡,用CH3OH表示的平均反应速率V(CH3OH)=$\frac{△C}{△t}$=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),而化学反应速率之比等于计量数之比,故V(H2)=3V(CH3OH)=0.225mol/(L•min),故D正确;
故选D.
点评 本题考查了根据图象判断反应吸放热以及温度的改变对K的影响,应注意的是K只受温度的影响,其它因素的改变所引起的平衡的移动,K不变.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 无色透明的溶液中:MnO4-、SO42-、Na+、H+ | |
| D. | $\frac{KW}{c(H+)}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
17.向100mL1mol/L的AlCl3溶液中逐渐加入浓度为2mol/L的NaOH溶液,若产生3.9g白色沉淀,则加入的NaOH溶液的体积可能为( )
| A. | 30mL | B. | 55mL | C. | 65mL | D. | 175mL |
14.高铁电池是一种可逆电池,该电池能长时间保持稳定的放电电压.高铁电池总反应为3Zn+2K2Fe04+8H20?3Zn(OH)2+2Fe(OH)3+4KOH.下列判断不正确的是( )
| A. | 放电时,负极反应为2n-2e-+20H一═Zn(OH)2 | |
| B. | 充电时,阴极pH增大 | |
| C. | 放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 | |
| D. | 充电时,阳极反应为Fe(OH)3+50H一+3e一=Fe042-+4H20 |
1.下列反应的离子方程式书写正确的是( )
| A. | 小苏打和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化铝溶于强碱:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与醋酸反应:CO32-+2H+═H2O+CO2↑ |
 有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验
有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验