题目内容
7.将14克Na2O、Na2O2的混合物放入87.6克水中,可得1.12升氧气(标准状况),所得溶液的密度为1.18克/毫升,求原混合物中各成分的物质的量之比和所得溶液的质量分数和物质的量浓度.分析 由氧气体积可知氧气物质的量,根据2Na2O2+2H2O=4NaOH+O2↑计算过氧化钠的物质的量,进而计算Na2O的质量,再根据n=$\frac{m}{M}$计算氧化钠的物质的量;
根据钠离子守恒计算n(NaOH),根据m=nM计算NaOH的质量,溶液质量=固体质量+水的质量-生成氧气的质量,溶液质量分数=$\frac{NaOH质量}{溶液总质量}$×100%;
根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算NaOH的物质的量浓度.
解答 解:标况下,1.12L 氧气物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,
2Na2O2+2H2O=4NaOH+O2↑
2 1
0.1mol 0.05mol
故混合物中Na2O的质量为14g-0.1mol×78g/mol=6.2g,则n(Na2O)=$\frac{6.2g}{62g/mol}$=0.1mol,
则原混合物中n(Na2O):n(Na2O2)=0.1mol:0.1mol=1:1;
根据钠离子守恒:n(NaOH)=2n(Na2O)+2n(Na2O2)=2(0.1mol+0.1mol)=0.4mol,
则m(NaOH)=0.4mol×40g/mol=15$\frac{0.4mol}{\frac{1}{1.18}L}$g,
溶液质量=14g+87.6g-0.05mol×32g/mol=100g
故所得溶液中NaOH的质量分数为$\frac{16g}{100g}$×100%=16%;
溶液体积为$\frac{100g}{1180g/L}$=$\frac{1}{1.18}$L,则c(NaOH)=$\frac{0.4mol}{\frac{1}{1.18}L}$=0.472mol/L,
答:原混合物中n(Na2O):n(Na2O2)=1:1;
所得溶液中NaOH的质量分数为16%;
溶液中NaOH的物质的量浓度为0.472mol/L.
点评 本题考查混合物有关计算,明确发生的反应即可解答,正确计算反应后溶液质量为解答关键,试题侧重考查学生分析计算能力.

| A. | 都具有脱水性 | |
| B. | 在加热条件下都能与碳反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65g固体.
据此,该同学得到的结论正确的是( )
| A. | 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀中一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要判断原溶液中是否有Cl-,无需另外设计实验验证 | |
| D. | 原溶液中一定有K+,且c(K+)≥0.4 mol•L-1 |
| A. | 23g金属钠 | B. | 1mol/L BaCl2溶液100mL | ||
| C. | 56g金属铁 | D. | 20% NaOH溶液50g |
| A. | 2,2-甲基-3-乙基丁烷 | B. | 2-甲基-3-乙基戊烷 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2,3,4-3甲基丁烷 |
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于浓盐酸中,然后稀释至所需浓度 | |
| C. | pH=9的CH3COONa溶液和PH=9的NaOH溶液中,水的电离程度相当 | |
| D. | 以金属铝为阳极电解足量的NaOH溶液,阳极区域没有沉淀生成 |
| A. | 用过量氨水吸收SO2:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 铁和稀硝酸反应后,溶液pH=2 Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| D. | 向银氨溶液中加入盐酸[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.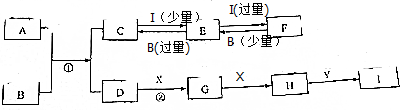
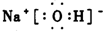 ;
;