题目内容
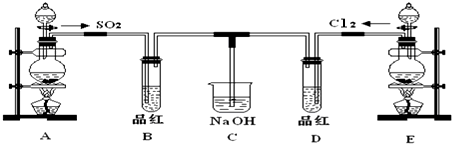
18. 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.(1)实验室用亚硫酸钠固体和一定浓度的硫酸反应制备SO2气体,写出该反应的化学方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
(2)分别将SO2气体通入下列溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是变红.
②SO2通入氯水溶液,现象是浅黄绿色褪去,其反应的离子方程式为SO2+Cl2+2H2O═4H++SO42-+2Cl-.
③过量SO2慢慢地通入澄清石灰水中,现象是先变浑浊,后又变澄清.
④若C取双氧水,则通入SO2后,请大胆判断所得溶液是H2SO4(填溶质的化学式),若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有碳酸钠或碳酸氢钠.
分析 (1)亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,强酸制取弱酸;
(2)①二氧化硫和水反应生成亚硫酸,紫色石蕊试液遇酸变红色;二氧化硫有漂白性,但不能使石蕊褪色;
②二氧化硫有还原性,氯气有强氧化性,所以二氧化硫和氯气能发生氧化还原反应生成硫酸和氯化氢,氯水的淡黄绿色褪去;
③二氧化硫和二氧化碳有相似性,都能使澄清的石灰水变浑浊,继续通入二氧化硫,二氧化硫和亚硫酸钙反应生成可溶性的亚硫酸氢钙;
④二氧化硫有还原性,双氧水有强氧化性,所以二氧化硫和双氧水能发生氧化还原反应生成硫酸;碳酸盐和碳酸氢盐能与硫酸反应生成二氧化碳;
解答 解:(1)亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)①二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液显酸性,紫色石蕊试液遇酸变红色,所以溶液会变红,
故答案为:变红;
②二氧化硫有还原性,氯气有强氧化性,所以二氧化硫和氯气能发生氧化还原反应,氯水浅黄绿色褪去,离子反应方程式为:SO2+Cl2+2H2O═SO42-+2Cl-+4H+,
故答案为:浅黄绿色褪去,SO2+Cl2+2H2O═SO42-+2Cl-+4H+;
③二氧化硫和氢氧化钙反应生成不溶于水的亚硫酸钙和水,亚硫酸钙和二氧化硫、水能反应生成可溶性的亚硫酸氢钙,离子反应方程式为:Ca2++2OH-+SO2=CaSO3 ↓+H2O;CaSO3+SO2+H20=Ca2++2HSO3-,
故答案为:先变浑浊,后又变澄清;
④二氧化硫有还原性,双氧水有强氧化性,所以二氧化硫和双氧水能发生氧化还原反应生成硫酸;碳酸盐和碳酸氢盐能与硫酸反应生成二氧化碳,若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有碳酸盐或碳酸氢盐;
故答案为:H2SO4;碳酸钠或碳酸氢钠;
点评 本题考查了二氧化硫的性质,难度不大,注意二氧化硫有漂白性,但二氧化硫不能漂白石蕊试液.

 作业辅导系列答案
作业辅导系列答案| A. | 水玻璃和硫酸亚铁溶液长期暴露在空气中均易变质 | |
| B. | SO2和CO2通入CaCl2溶液中均无明显现象 | |
| C. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| D. | SO2、漂白粉、活性炭都能使红墨水褪色 |
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、Fe2+、Cl-、NO3- | |
| C. | 在水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH${\;}_{4}^{+}$)大小顺序为:①>②>③ | |
| D. | 10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20 mL |
| A. | 碳酸钙难溶于水,所以碳酸钙属于非电解质 | |
| B. | 溶于水能电离出氢离子的化合物都是酸 | |
| C. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化 | |
| D. | 将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝 |