题目内容
下列叙述正确的是( )


| A、K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B、K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑ |
| C、K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑ |
| D、K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:K与N连接时,该装置为原电池,铁易失电子作负极,石墨作正极,正极上得电子发生还原反应;
K与M连接时,该装置为电解池,石墨作阳极铁作阴极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应.
K与M连接时,该装置为电解池,石墨作阳极铁作阴极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应.
解答:
解:A.K与N连接时,该装置为原电池,X为硫酸溶液时,铁失电子生成亚铁离子,正极上氢离子得电子生成氢气,导致溶液中氢离子浓度减小,溶液的pH增大,故A错误;
B.K与N连接时,该装置是原电池,X为氯化钠,铁发生吸氧腐蚀,铁作负极,正极上氧气得电子生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,故B错误;
C.K与M连接时,该装置为电解池,X为氯化钠,石墨作阳极铁作阴极,石墨电极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,故C错误;
D.K与M连接时,该装置为电解池,X为硫酸,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解水,硫酸的浓度逐渐增大,则溶液的pH减小,故D正确;
故选D.
B.K与N连接时,该装置是原电池,X为氯化钠,铁发生吸氧腐蚀,铁作负极,正极上氧气得电子生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,故B错误;
C.K与M连接时,该装置为电解池,X为氯化钠,石墨作阳极铁作阴极,石墨电极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,故C错误;
D.K与M连接时,该装置为电解池,X为硫酸,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解水,硫酸的浓度逐渐增大,则溶液的pH减小,故D正确;
故选D.
点评:本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,再结合得失电子、电解质的性质书写电极反应式,为学习难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式正确的是( )
| A、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| B、钢铁在潮湿的环境下发生吸氧腐蚀的正极反应:O2+4e-=2O2- |
| C、足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl- |
| D、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2H+ |
下列有关Cl2的实验操作和装置中,正确的是( )
A、 闻Cl2气味 |
B、 除去Cl2中的HCl |
C、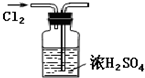 干燥Cl2 |
D、 用高锰酸钾和浓盐酸快速制取Cl2 |
下列反应的离子方程式书写正确的是( )
| A、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| B、硫化钠溶于水中:S2-+2H2O?H2S+2OH- | ||||
C、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO
| ||||
D、用铜作电极电解饱和硫酸铜溶液:Cu+2H2O
|
下列解释事实或实验现象的化学用语正确的是( )
| A、将过氧化钠加入到滴有酚酞的水中,溶液变红Na2O2+H2O═2Na++2OH-+O2↑ |
| B、实验室用硫酸铝溶液和氨水反应制取氢氧化铝Al3++3OH-═Al(OH)3↓ |
| C、实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-═SiO32-+H2O |
| D、钢铁表面的水膜酸性较强时,水膜中的H+会被还原O2+4H++4e-═2H2O |
下列说法正确的是( )
| A、1mol硫酸钾中阳离子所带的正电荷数为6.02×1023 |
| B、1L 0.1mol?L-1 AlCl3溶液中含有0.1×6.02×1023个Al3+ |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为6.02×1023 |
| D、H2O2催化分解生成0.2mol O2时转移电子的数目为0.8×6.02×1023 |
