题目内容
下列有关Cl2的实验操作和装置中,正确的是( )
A、 闻Cl2气味 |
B、 除去Cl2中的HCl |
C、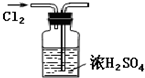 干燥Cl2 |
D、 用高锰酸钾和浓盐酸快速制取Cl2 |
考点:化学实验方案的评价,氯气的实验室制法,物质的分离、提纯和除杂,气体的净化和干燥
专题:实验评价题,化学实验基本操作
分析:A.闻气体气味时应避免中毒;
B.氯气和氯化氢与氢氧化钠溶液都反应;
C.气体的进出方向错误;
D.高锰酸钾与浓盐酸可在常温下发生氧化还原反应生成氯气.
B.氯气和氯化氢与氢氧化钠溶液都反应;
C.气体的进出方向错误;
D.高锰酸钾与浓盐酸可在常温下发生氧化还原反应生成氯气.
解答:
解:A.闻气体气味时应用手在瓶口轻轻扇动,使少量气体飘进鼻孔,避免中毒,故A错误;
B.氯气和氯化氢与氢氧化钠溶液都反应,应用饱和食盐水除杂,故B错误;
C.干燥氯气时,气体应从长导管进入,故C错误;
D.高锰酸钾与浓盐酸可在常温下发生氧化还原反应生成氯气,可用于制备气体,故D正确.
故选D.
B.氯气和氯化氢与氢氧化钠溶液都反应,应用饱和食盐水除杂,故B错误;
C.干燥氯气时,气体应从长导管进入,故C错误;
D.高锰酸钾与浓盐酸可在常温下发生氧化还原反应生成氯气,可用于制备气体,故D正确.
故选D.
点评:本题考查较为综合,涉及物质的制备、除杂等实验操作,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,除杂时不能引入新的杂质,难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
下列有关实验的说法正确的是( )
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
下列事实,不能用平衡移动原理解释的是( )
| A、加催化剂,使N2和H2在一定条件下转化为NH3 |
| B、CaCO3难溶于水,易溶于盐酸 |
| C、将氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| D、打开碳酸饮料会有大量气泡冒出 |
下列离子方程式正确的是( )
| A、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| D、等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
下列叙述正确的是( )


| A、K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B、K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑ |
| C、K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑ |
| D、K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
不同元素的原子间最本质的区别是( )
| A、中子数不同 |
| B、相对原子质量不同 |
| C、质子数不同 |
| D、最外层电子数不同 |
 已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q. 如图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写:
如图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写: