题目内容
下列离子方程式正确的是( )
| A、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| B、钢铁在潮湿的环境下发生吸氧腐蚀的正极反应:O2+4e-=2O2- |
| C、足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl- |
| D、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2H+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸氢钠完全反应,生成碳酸钡、水、NaOH;
B.氧气得到电子生成OH-;
C.少量的氯气,只氧化亚铁离子;
D.发生氧化还原反应,生成硫酸钙和盐酸.
B.氧气得到电子生成OH-;
C.少量的氯气,只氧化亚铁离子;
D.发生氧化还原反应,生成硫酸钙和盐酸.
解答:
解:A.碳酸氢钠溶液与足量氢氧化钡溶液混合的离子反应为HCO3-+Ba2++OH-=BaCO3↓+H2O,故A正确;
B.钢铁在潮湿的环境下发生吸氧腐蚀的正极反应为O2+H2O+4e-=4OH-,故B错误;
C.足量的溴化亚铁和少量的氯气反应的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;
D.ClO-有强氧化性,少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+H2O+Ca2++ClO-=CaSO4↓+2H++Cl-,故D错误;
故选A.
B.钢铁在潮湿的环境下发生吸氧腐蚀的正极反应为O2+H2O+4e-=4OH-,故B错误;
C.足量的溴化亚铁和少量的氯气反应的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;
D.ClO-有强氧化性,少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+H2O+Ca2++ClO-=CaSO4↓+2H++Cl-,故D错误;
故选A.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应书写,综合性较强,较好的训练学生思维的严密性,有利于分析能力的培养,选项D为解答的难点,题目难度不大.

练习册系列答案
 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列有关环境保护与绿色化学的叙述不正确的是( )
| A、形成酸雨的主要物质是硫的氧化物和氮的氧化物 |
| B、大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气 |
| C、绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
| D、水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
下列有关实验的说法正确的是( )
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、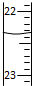 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
下列事实,不能用平衡移动原理解释的是( )
| A、加催化剂,使N2和H2在一定条件下转化为NH3 |
| B、CaCO3难溶于水,易溶于盐酸 |
| C、将氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| D、打开碳酸饮料会有大量气泡冒出 |
下列叙述正确的是( )


| A、K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B、K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑ |
| C、K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑ |
| D、K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
 已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q. (1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:
(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题: