题目内容
下列反应的离子方程式书写正确的是( )
| A、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| B、硫化钠溶于水中:S2-+2H2O?H2S+2OH- | ||||
C、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO
| ||||
D、用铜作电极电解饱和硫酸铜溶液:Cu+2H2O
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.醋酸在离子反应中保留化学式;
B.硫离子水解分步进行,以第一步为主;
C.Ba(OH)2完全反应,反应生成硫酸钡和水;
D.用铜作电极电解饱和硫酸铜溶液,阳极Cu失去电子、阴极上铜离子得到电子.
B.硫离子水解分步进行,以第一步为主;
C.Ba(OH)2完全反应,反应生成硫酸钡和水;
D.用铜作电极电解饱和硫酸铜溶液,阳极Cu失去电子、阴极上铜离子得到电子.
解答:
解:A.醋酸是弱电解质,写离子方程式时不能拆分,故醋酸溶液与水垢中的CaCO3反应的离子反应为
CaCO3+2HAc═Ca2++H2O+CO2↑+2Ac-,故A错误;
B.弱酸根离子的水解要分步进行,故硫化钠溶于水中的离子反应应为S2-+H2O?HS-+OH-,故B错误;
C.过量的NaHSO4溶液,可以提供足够的H+使OH-完全中和,与Ba(OH)2溶液反应的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D.用铜作电极电解饱和硫酸铜溶液,阳极上Cu-2e-=Cu2+,阴极上发生Cu2++2e-=Cu,故D错误;
故选C.
CaCO3+2HAc═Ca2++H2O+CO2↑+2Ac-,故A错误;
B.弱酸根离子的水解要分步进行,故硫化钠溶于水中的离子反应应为S2-+H2O?HS-+OH-,故B错误;
C.过量的NaHSO4溶液,可以提供足够的H+使OH-完全中和,与Ba(OH)2溶液反应的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D.用铜作电极电解饱和硫酸铜溶液,阳极上Cu-2e-=Cu2+,阴极上发生Cu2++2e-=Cu,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重水解、电解及与量有关的离子反应书写,综合性较强,较好的训练学生思维的严密性,有利于分析能力的培养,选项D为解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关实验的说法正确的是( )
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、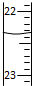 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
下列离子方程式正确的是( )
| A、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| D、等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
下列叙述正确的是( )


| A、K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B、K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑ |
| C、K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑ |
| D、K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
下列各组离子中,在给定条件下可能大量共存的是( )
| A、在pH=2的溶液中:NH4+、K+、ClO-、Cl- |
| B、加入铝粉有氢气生成的溶液:CO32-、Cl-、K+、Na+ |
| C、由水电离产生的c(OH-)=1×10-15mol/L的溶液:Fe2+、Na+、NO3-、Cl- |
| D、加入NH4HCO3有气体生成的无色溶液:Cl-、Cu2+、H+、SO42- |
不同元素的原子间最本质的区别是( )
| A、中子数不同 |
| B、相对原子质量不同 |
| C、质子数不同 |
| D、最外层电子数不同 |
将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后溶液呈碱性,下列关系式中不正确的是( )
| A、c(HCN)>c(CN-) |
| B、c(Na+)>c(CN-) |
| C、c(HCN)-c(CN-)=c(OH-) |
| D、c(HCN)+c(CN-)=0.1mol/L |
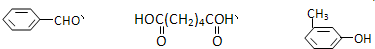
 互为同分异构体的是
互为同分异构体的是 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示: