题目内容
5.下列反应属于氧化还原反应的是( )| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断.
解答 解:A.CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2,C、H元素的化合价发生变化,属于氧化还原反应,故A正确;
B.CaCO3+H2O+CO2═Ca(HCO3)2为化合反应,反应中不存在化合价变化,不属于氧化还原反应,故B错误;
C.CuO+2HCl═CuCl2+H2O为复分解反应,不存在化合价变化,不属于氧化还原反应,故C错误;
D.CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑为分解反应,反应中不存在化合价变化,不属于氧化还原反应,故D错误;
故选A.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握四种基本反应类型与氧化还原反应之间的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
15.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:
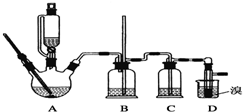
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
16.下列说法不正确的是( )
| A. | 碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大 | |
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 与外界隔离的体系,自发过程将导致体系的熵减小 | |
| D. | 在一定条件下,非自发进行的反应也能够发生 |
13.将4mol A和2mol B在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(s)+B(g)?2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
| A. | 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示2s内的平均反应速率为0.6 mol/(L•s) | |
| C. | 2 s后物质B的浓度为0.35 mol/L | |
| D. | 2 s后物质A的转化率为30% |
20.下列说法正确的是( )
| A. | 钠和铁都是具有多种化合价金属,所同条件下与氧气反应时能得到不同的产物 | |
| B. | 将钠暴露在空气中,表面形成较为疏松的氧化膜,不能阻止其被继续氧化 | |
| C. | 钠元素的化学性质活泼,主要表现为具有还原性 | |
| D. | 金属铝的化学性质稳定,可以用来做日常用的铝制品 |
10.下列关于胶体的叙述中,不正确的是( )
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
17.某温度下,水的离子积常数KW=1×10-12.该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A. | 1:10 | B. | 9:1 | C. | 1:9 | D. | 99:21 |
14.与氢氧根具有相同的质子数和电子数的微粒是( )
| A. | CH4 | B. | NH4+ | C. | Cl- | D. | NH2- |
17.在一密闭容器中,反应aA(g)+bB(g)?cB(g)+dD(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
| A. | D的浓度减小了 | B. | A的转化率减小了 | ||
| C. | 物质B的质量分数增加了 | D. | a+b>c+d |