题目内容
17.在一密闭容器中,反应aA(g)+bB(g)?cB(g)+dD(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )| A. | D的浓度减小了 | B. | A的转化率减小了 | ||
| C. | 物质B的质量分数增加了 | D. | a+b>c+d |
分析 先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向逆反应方向移动,则a+b>c,据此结合选项判断.
解答 解:先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向逆反应方向移动,则a+b>c,
A.D为固体,D的浓度不变,故A错误;
B.由分析可知,平衡向逆反应移动,A的转化率减小,故B正确;
C.平衡向逆反应移动,气体的总质量增大,B的质量也增大,所以不能判断B的质量分数是否增大,故C错误;
D.由分析可知,减小压强平衡向逆反应方向移动,则a+b>c,但是a+b与c+d的关系不能确定,故D错误;
故选B.
点评 本题考查了压强对化学平衡移动的影响,题目难度不大,注意通过改变体积引起浓度的变化判断平衡移动的方向,此为解答该题的关键.

练习册系列答案
相关题目
5.下列反应属于氧化还原反应的是( )
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
2.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.
它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
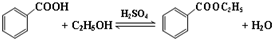
相关物质的部分物理性质如表格:
实验流程如下:

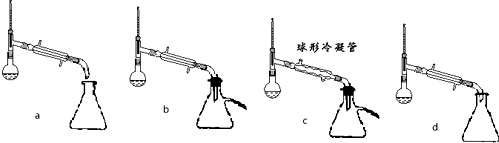
(1)制备苯甲酸乙酯,下列装置最合适的是B,带“分水器”的冷凝回流装置与一般的冷凝装置相比,主要优点在于分离出生成的水,促进酯化反应向正向进行
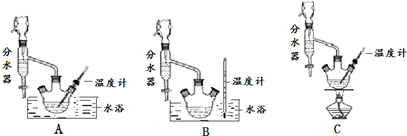
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,加入无水MgSO4.乙醚的作用是萃取出水层中溶解的苯甲酸乙酯,提高产率
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因为苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品.
(7)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
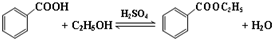
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |
实验流程如下:

(1)制备苯甲酸乙酯,下列装置最合适的是B,带“分水器”的冷凝回流装置与一般的冷凝装置相比,主要优点在于分离出生成的水,促进酯化反应向正向进行

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,加入无水MgSO4.乙醚的作用是萃取出水层中溶解的苯甲酸乙酯,提高产率
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因为苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品.
(7)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.