题目内容
17.某温度下,水的离子积常数KW=1×10-12.该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )| A. | 1:10 | B. | 9:1 | C. | 1:9 | D. | 99:21 |
分析 该温度下,水的离子积常数KW=1×10-12,纯水pH=-lgc(H+)=-lg$\sqrt{{K}_{w}}$=-lg$\sqrt{1{0}^{-12}}$=6,pH=4的H2SO4溶液中c(H+)=10-pH=10-4 mol/L,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3 mol/L,混合并保持恒温,混合溶液的pH=7>6,溶液呈碱性,则混合溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,据此计算稀硫酸和氢氧化钠溶液体积之比.
解答 解:该温度下,水的离子积常数KW=1×10-12,纯水pH=-lgc(H+)=-lg$\sqrt{{K}_{w}}$=-lg$\sqrt{1{0}^{-12}}$=6,pH=4的H2SO4溶液中c(H+)=10-pH=10-4 mol/L,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3 mol/L,混合并保持恒温,混合溶液的pH=7>6,溶液呈碱性,则混合溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,设稀硫酸、NaOH溶液体积为xL、yL,
c(OH-)=$\frac{1{0}^{-3}y-1{0}^{-4}x}{x+y}$mol/L=10-5 mol/L,
x:y=9:1,
故选B.
点评 本题考查酸碱混合溶液定性判断及pH值的有关计算,侧重考查学生分析计算能力,明确混合溶液pH值计算方法是解本题关键,注意该温度下pH=7的溶液呈碱性而不是中性,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 60% | B. | 40% | C. | 30% | D. | 70% |
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
| 装置 | 操作 | 现象 |
 | 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
| A. | 烧杯A中发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 红棕色气体消失只与NO2和烧杯C中的KI发生反应有关 | |
| C. | 烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关 | |
| D. | 若将铜片换成铁片,则C中的液体也可能变蓝 |
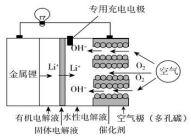 锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )
锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )| A. | 电池工作时,正极反应式:O2+2H2O+4e-=4OH- | |
| B. | 去掉固体电解液和有机电解质,电池反应发生改变 | |
| C. | 充电时,生成14 g Li,空气极质量增加16 g | |
| D. | 充电时,专用充电电极可以有效防止空气极腐蚀和劣化 |