题目内容
20.下列贡献与中国科学家无关的是( )| A. | 创立侯氏制碱法 | B. | 发现青蒿素 | ||
| C. | 合成结晶牛胰岛素 | D. | 发明元素周期表 |
分析 A、侯德榜发现了侯氏制碱法;
B、屠呦呦发现青蒿素;
C、中国科学家最早人工合成结晶牛胰岛素;
D、门捷列夫制出了第一张元素周期表.
解答 解:A、中国科学家侯德榜发现了侯氏制碱法,故侯氏制碱法和中国科学家有关,故A错误;
B、中国科学家屠呦呦发现青蒿素,获得了诺贝尔奖,故B错误;
C、中国科学家最早人工合成结晶牛胰岛素,故和中国科学家有关,故C错误;
D、俄国科学家门捷列夫制出了第一张元素周期表,和中国科学家无关,故D正确.
故选D.
点评 本题考查了常见的化学史,注意基础知识的积累并关注科学动态的发展,难度不大,

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
10.向饱和NaOH溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( )
| A. | 溶液的溶质质量分数变大 | B. | 溶液仍为饱和溶液 | ||
| C. | 溶液中的Na+数目减小 | D. | 溶液中的c(Na+)增大 |
11.下列说法正确的是 ( )
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 可溶于水的盐都是强电解质 | |
| C. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 | |
| D. | 熔融的电解质都能导电 |
15.将CH4、CO2催化重整为可用的化学品,对缓解能源危机、改善环境意义重大.
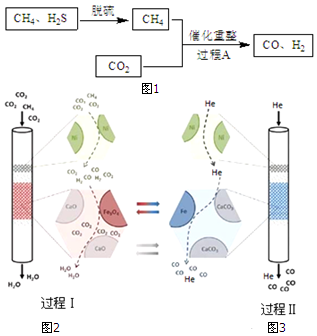
(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
运用有关化学原理解释实验结果:过程Ⅰ中存在平衡4CO+Fe3O4?3Fe+4CO2,添加的CaO与CO2结合成CaCO3,降低了c(CO2),使平衡正向移动,所以有Fe生成,使Fe3O4催化作用更好.

(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
5.涤纶广泛应用于衣料和装饰材料.合成涤纶的反应如下:n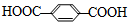 +nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
+nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
 +nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
+nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )| A. | 合成涤纶的反应为加聚反应 | |
| B. | 对苯二甲酸和苯甲酸互为同系物 | |
| C. | 1 mol涤纶与NaOH溶液反应,理论上最多可消耗2n mol NaOH | |
| D. | 涤纶的结构简式为: |
12.分别进行如下表所示实验,根据实验现象得出的结论正确的是( )
| 选项 | 试验操作 | 现象 | 结论 |
| A | 向浓度为0.1molL-1MgSO4、CuSO4混合溶液中逐滴加入NaOH溶液 | 先看到蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 测量熔融状态下NaHSO4 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、SO42- |
| C | 向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变化 | 原溶液中无NH4+ |
| D | 向Fe(NO)2溶液中加入0.1mol•L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
9.通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJ•mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJ•mol-1
则下列说法正确的是( )
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJ•mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJ•mol-1
则下列说法正确的是( )
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8kJ•mol-1 | |
| C. | 对反应b来说,增大O2浓度可使△H2的值增大 | |
| D. | 以上两种途径,制取等量的氢气,无论哪种途径,消耗的能量均相同. |
8.氮氧化合物对环境的损害作用极大.下列环境问题中氮氧化合物不是“重要成员”的是( )
| A. | 酸雨 | B. | 光化学烟雾 | C. | 臭氧空洞 | D. | 温室效应 |
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空: