题目内容
12.分别进行如下表所示实验,根据实验现象得出的结论正确的是( )| 选项 | 试验操作 | 现象 | 结论 |
| A | 向浓度为0.1molL-1MgSO4、CuSO4混合溶液中逐滴加入NaOH溶液 | 先看到蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 测量熔融状态下NaHSO4 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、SO42- |
| C | 向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变化 | 原溶液中无NH4+ |
| D | 向Fe(NO)2溶液中加入0.1mol•L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先看到蓝色沉淀生成,说明氢氧化铜更难溶,结合溶度积越小越难溶分析;
B.熔融状态下硫酸氢钠电离出钠离子和硫酸氢根离子;
C.应该在浓氢氧化钠溶液、加热条件下检验铵根离子;
D.稀硝酸与亚铁离子反应生成的NO,NO与空气中氧气转化成红棕色的二氧化氮气体.
解答 解:A.向浓度为0.1molL-1MgSO4、CuSO4混合溶液中逐滴加入NaOH溶液,先看到蓝色沉淀生成,说明优先生成氢氧化铜沉淀,则氢氧化铜的溶解度较小,即Ksp[Cu(OH)2]<Ksp[Mg(OH)2],故A正确;
B.熔融状态下NaHSO4能够电离出Na+、HSO4-,所以能够导电,但熔融状态下硫酸氢根离子不电离,故B错误;
C.氨气极易溶于水,检验铵根离子时应该用浓NaOH溶液并加热,否则无法判断原溶液中是否含有NH4+,故C错误;
D.向Fe(NO)2溶液中加入0.1mol•L-1H2SO4溶液,形成的硝酸为稀硝酸,则反应生成的气体为NO,试管口出现红棕色气体是由于NO与氧气反应生成二氧化氮,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及难溶物溶度积比较、离子检验、硝酸性质等知识,明确常见元素及其化合物性质即可解答,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
3.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
20.下列贡献与中国科学家无关的是( )
| A. | 创立侯氏制碱法 | B. | 发现青蒿素 | ||
| C. | 合成结晶牛胰岛素 | D. | 发明元素周期表 |
17.根据下列实验现象所得出的结论错误的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO2溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO2 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO${\;}_{3}^{-}$被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
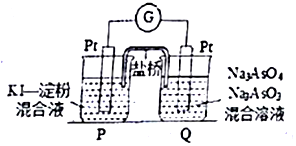 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)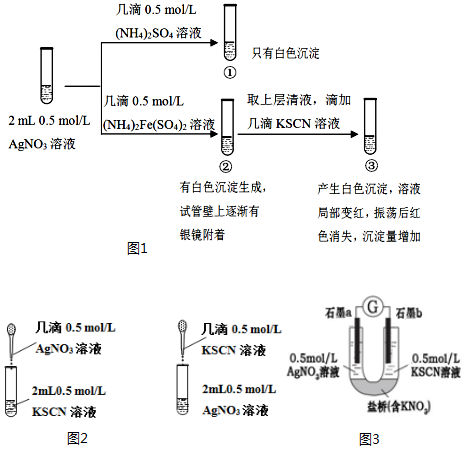
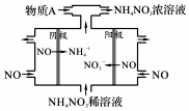 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一. .
.