题目内容
FeS04?7H20广泛用于医药和工业领域,以下是FeS04?7H20的实验室制备流程图.根据题意完成下列填空:
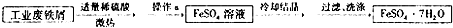
(1)铁屑与稀硫酸反应前,应用10% Na2C03溶液浸泡几分钟,操作目的是 ,浸泡后,用 (填操作方法)分离并洗涤铁屑.
(2)操作a为 .
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② .
(4)FeS04?7H20是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量.
I.方案一:可用KMn04溶液进行氧化还原滴定.在配制100mL 1.00×10-2mol?L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有 (填仪器名称).在配制过程中,下列说法正确的是 (填序号字母).
A.KMnO4溶于水不放热,可以直接在容量瓶中溶解
B.容量瓶洗涤后不需干燥即可直接用于实验
C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
D.如果定容时加水超过刻度线必须毓配制、
Ⅱ.方案二:将FeS04?7H20最终转化为Fe203,测定质量变化,操作流程如下:
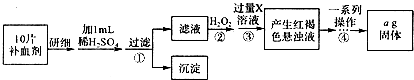
①步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).
③若步骤③加人X溶液的量不足,则最后测出每片补血剂含铁元素的质量将 (填“偏大”.“偏小”或“不变”).
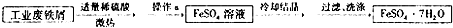
(1)铁屑与稀硫酸反应前,应用10% Na2C03溶液浸泡几分钟,操作目的是
(2)操作a为
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②
(4)FeS04?7H20是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量.
I.方案一:可用KMn04溶液进行氧化还原滴定.在配制100mL 1.00×10-2mol?L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有
A.KMnO4溶于水不放热,可以直接在容量瓶中溶解
B.容量瓶洗涤后不需干燥即可直接用于实验
C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
D.如果定容时加水超过刻度线必须毓配制、
Ⅱ.方案二:将FeS04?7H20最终转化为Fe203,测定质量变化,操作流程如下:

①步骤④中一系列操作依次是:过滤、洗涤、
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量
③若步骤③加人X溶液的量不足,则最后测出每片补血剂含铁元素的质量将
考点:硫酸亚铁的制备
专题:实验题
分析:(1)碳酸钠溶液中碳酸根离子水解显碱性,能洗去油污;分离并洗涤铁屑方法是倾析法;
(2)根据操作a的目的是固液分离来分析;
(3)最后得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(4)Ⅰ.依据配制溶液的过程和步骤选择仪器;依据溶液配制的实验过程判断;
A、容量瓶不能用来溶解物质;
B、只要最后让溶液体积是100ml即可,容量瓶中事先有水没影响;
C、定容后摇匀后不需要再加水,加水后溶液浓度减小;
D、加水超出刻度,配制失败需要重新配制;
Ⅱ.①题干要求将FeS04?7H20最终转化为Fe203,测定质量变化,据此分析;
②根据变化过程中铁元素的守恒来计算;
③根据加入X试剂的目的是使Fe3+沉淀来分析.
(2)根据操作a的目的是固液分离来分析;
(3)最后得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(4)Ⅰ.依据配制溶液的过程和步骤选择仪器;依据溶液配制的实验过程判断;
A、容量瓶不能用来溶解物质;
B、只要最后让溶液体积是100ml即可,容量瓶中事先有水没影响;
C、定容后摇匀后不需要再加水,加水后溶液浓度减小;
D、加水超出刻度,配制失败需要重新配制;
Ⅱ.①题干要求将FeS04?7H20最终转化为Fe203,测定质量变化,据此分析;
②根据变化过程中铁元素的守恒来计算;
③根据加入X试剂的目的是使Fe3+沉淀来分析.
解答:
解:(1)碳酸钠溶液中碳酸根离子水解显碱性,用10% Na2C03溶液浸泡铁屑的目的是能洗去油污;分离固液并洗涤铁屑方法是倾析法;故答案为:除去废铁屑表面的油污,倾析法;
(2)操作a的目的是将FeS04溶液与不溶性杂质分离,为了使FeS04的损失尽可能减小,故操作a应是趁热过滤,故答案为:趁热过滤;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4?7H2O的损耗;
(4)Ⅰ.配制100mL 1.00×10-2mol?L-1的KMnO4溶液,所用的仪器有天平、烧杯、胶头滴管、100mL容量瓶 玻璃棒;
A、容量瓶不能用来溶解物质,故A错误;
B、容量瓶是准确量配制溶液的量具,只需最后让溶液体积是100ml即可,容量瓶中事先有水没影响,故B正确;
C、定容后摇匀后不需要再加水,加水后溶液浓度减小,故C错误;
D、加水超出刻度,配制失败需要重新配制,故D正确;
故答案为:100ml容量瓶,胶头滴管;BD;
Ⅱ.①将FeS04?7H20最终转化为Fe203来测定质量变化,而红褐色悬浊液是Fe(OH)3,故要转化为Fe203,则需过滤、洗涤、灼烧、冷却、称量,故答案为:灼烧;
②根据铁元素的守恒,根据十片补血剂得到的Fe203的质量为ag,则每片补血剂得到的Fe203的质量为0.1ag,故含有的铁元素的质量m=
×2×56g/mol=0.07ag,故答案为:0.07g;
③加入X试剂的目的是使Fe3+沉淀,故若加人X溶液的量不足,则导致Fe3+沉淀不完全,测出每片补血剂含铁元素的质量将偏小,故答案为:偏小.
(2)操作a的目的是将FeS04溶液与不溶性杂质分离,为了使FeS04的损失尽可能减小,故操作a应是趁热过滤,故答案为:趁热过滤;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4?7H2O的损耗;
(4)Ⅰ.配制100mL 1.00×10-2mol?L-1的KMnO4溶液,所用的仪器有天平、烧杯、胶头滴管、100mL容量瓶 玻璃棒;
A、容量瓶不能用来溶解物质,故A错误;
B、容量瓶是准确量配制溶液的量具,只需最后让溶液体积是100ml即可,容量瓶中事先有水没影响,故B正确;
C、定容后摇匀后不需要再加水,加水后溶液浓度减小,故C错误;
D、加水超出刻度,配制失败需要重新配制,故D正确;
故答案为:100ml容量瓶,胶头滴管;BD;
Ⅱ.①将FeS04?7H20最终转化为Fe203来测定质量变化,而红褐色悬浊液是Fe(OH)3,故要转化为Fe203,则需过滤、洗涤、灼烧、冷却、称量,故答案为:灼烧;
②根据铁元素的守恒,根据十片补血剂得到的Fe203的质量为ag,则每片补血剂得到的Fe203的质量为0.1ag,故含有的铁元素的质量m=
| 0.1ag |
| 160g/mol |
③加入X试剂的目的是使Fe3+沉淀,故若加人X溶液的量不足,则导致Fe3+沉淀不完全,测出每片补血剂含铁元素的质量将偏小,故答案为:偏小.
点评:本题考查一定物质的量浓度溶液的配制、守恒法的计算等,考查知识点较多,难度较大,且计算较繁琐,对学生的能力要求较高.

练习册系列答案
相关题目
对下列实验过程的评价,正确的是( )
| A、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| B、验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
| C、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| D、某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.