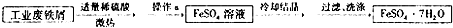题目内容
对下列实验过程的评价,正确的是( )
| A、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| B、验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
| C、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| D、某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
考点:化学实验方案的评价,物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题,实验评价题
分析:A.石蕊遇酸变红;
B.先加稀硝酸,排除干扰离子,再加硝酸银检验氯离子;
C.无色气体为二氧化碳,固体为碳酸盐或碳酸氢盐等;
D.白色沉淀可能为AgCl.
B.先加稀硝酸,排除干扰离子,再加硝酸银检验氯离子;
C.无色气体为二氧化碳,固体为碳酸盐或碳酸氢盐等;
D.白色沉淀可能为AgCl.
解答:
解:A.石蕊遇酸变红,则无色溶液滴入紫色石蕊试液显红色,该溶液可能显酸性,故A错误;
B.先加稀硝酸,排除干扰离子,再加硝酸银检验氯离子,试剂的加入顺序、现象、结论均合理,故B正确;
C.固体中加入稀盐酸,产生了无色气体,无色气体为二氧化碳,固体可能为碳酸盐或碳酸氢盐等,故C错误;
D.某溶液中滴加BaCl2溶液,生成白色沉淀,白色沉淀可能为AgCl或BaSO4,则溶液中可能含Ag+或SO42-,但二者不能同时存在,故D错误;
故选B.
B.先加稀硝酸,排除干扰离子,再加硝酸银检验氯离子,试剂的加入顺序、现象、结论均合理,故B正确;
C.固体中加入稀盐酸,产生了无色气体,无色气体为二氧化碳,固体可能为碳酸盐或碳酸氢盐等,故C错误;
D.某溶液中滴加BaCl2溶液,生成白色沉淀,白色沉淀可能为AgCl或BaSO4,则溶液中可能含Ag+或SO42-,但二者不能同时存在,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及指示剂的变色、离子检验等,把握离子检验的试剂、现象和结论的关系及实验技能为解答的关键,侧重实验基本技能的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质的分离可用分液漏斗的是( )
| A、乙醇和水 |
| B、苯和水 |
| C、硫酸钡与食盐水 |
| D、由海水蒸发获得淡水 |
t℃时,在体积不变的容器巾发生反应:X(g)+3Y(g)?2Z(g)△H<0各组分浓度如下表:
下列说法不正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.3 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | ||
| 平衡浓度/mol?L-1 | 0.1 |
| A、0~2min的平均速率v(X)=0.01mol?L-1?min-1 |
| B、达平衡时Y的转化率为50% |
| C、其它条件不变,升高温度,平衡逆向移动 |
| D、其它条件不变,增加X的浓度,v正增大v逆减小,平衡正向移动 |
将磁性氧化铁放入稀HNO3中可发生如下反应:Fe3O4+HNO3(稀)-Fe(NO3)3+NO↑+H2O(未配平),下列说法正确的是( )
| A、配平后的化学方程式为Fe3O4+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O |
| B、反应中每还原0.4 mol氧化剂,就有1.2 mol电子转移 |
| C、稀HNO3在反应中只表现氧化性 |
| D、磁性氧化铁中的所有铁元素全部被氧化 |
下列关于钠的氧化物叙述中正确的是( )
| A、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
| B、Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2 |
| C、Na2O有强还原性,Na2O2有强氧化性 |
| D、Na2O2可作供氧剂,而Na2O不能 |
常见金属R与硝酸银溶液反应的化学方程式为R+3AgNO3═3Ag+R(NO3)3,有关该反应的说法正确的是( )
| A、反应后溶液质量一定增加 |
| B、该金属可能是铁 |
| C、R的活泼性比Ag弱 |
| D、R表面有固体析出 |
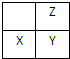 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |
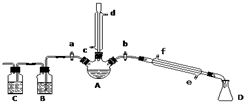 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答: