题目内容
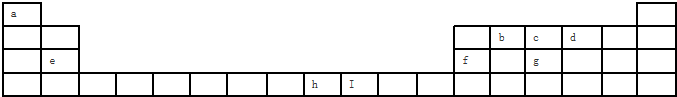
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序为 .
(2)⑥和⑦的最高价含氧酸的酸性强弱为 .
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为 .
(4)⑤的单质与氢氧化钠溶液反应的化学方程式为 .
(5)⑦的单质与氢氧化钠溶液反应的离子方程式为 .
(6)②与⑥最简单氢化物的稳定性强弱为 > .
(7)③与⑦氢化物的沸点高低为 > .
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)⑥和⑦的最高价含氧酸的酸性强弱为
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为
(4)⑤的单质与氢氧化钠溶液反应的化学方程式为
(5)⑦的单质与氢氧化钠溶液反应的离子方程式为
(6)②与⑥最简单氢化物的稳定性强弱为
(7)③与⑦氢化物的沸点高低为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素的原子按1:1组成的常见液态化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(6)非金属性越强,氢化物越稳定;
(7)HF分子之间存在氢键,沸点高于HCl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素的原子按1:1组成的常见液态化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(6)非金属性越强,氢化物越稳定;
(7)HF分子之间存在氢键,沸点高于HCl.
解答:
解:由元素在周期表中位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4 >H2SO4 ,故答案为:HClO4 >H2SO4 ;
(3)①、②两种元素的原子按1:1组成的常见液态化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,电子式为: ,故答案为:
,故答案为: ;
;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)非金属性O>S,非金属性越强,氢化物越稳定,故氢化物稳定性:H2O>H2S,故答案为:H2O>H2S;
(7)HF分子之间存在氢键,HCl分子之间存在范德华力,氢键比范德华力作用更强,故沸点HF>HCl,故答案为:HF>HCl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4 >H2SO4 ,故答案为:HClO4 >H2SO4 ;
(3)①、②两种元素的原子按1:1组成的常见液态化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,电子式为:
 ,故答案为:
,故答案为: ;
;(4)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)非金属性O>S,非金属性越强,氢化物越稳定,故氢化物稳定性:H2O>H2S,故答案为:H2O>H2S;
(7)HF分子之间存在氢键,HCl分子之间存在范德华力,氢键比范德华力作用更强,故沸点HF>HCl,故答案为:HF>HCl.
点评:本题考查元素周期表与元素周期律综合应用,难度不大,侧重对元素周期律的考查.

练习册系列答案
相关题目
将磁性氧化铁放入稀HNO3中可发生如下反应:Fe3O4+HNO3(稀)-Fe(NO3)3+NO↑+H2O(未配平),下列说法正确的是( )
| A、配平后的化学方程式为Fe3O4+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O |
| B、反应中每还原0.4 mol氧化剂,就有1.2 mol电子转移 |
| C、稀HNO3在反应中只表现氧化性 |
| D、磁性氧化铁中的所有铁元素全部被氧化 |
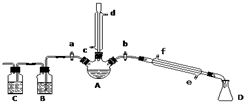 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答: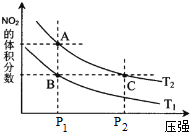
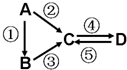 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
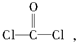 每个COCl2分子内含有
每个COCl2分子内含有