题目内容
甲醇是一种可再生能源,具有广泛的应用前景.工业上常用CO和H2反应生产CH3OH,并开发甲醇燃料电池.

(1)已知:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.0kJ/mol
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 .
(2)工业上常利用反应CO(g)+2H2(g)=CH3OH(g)△H<0合成甲醇,在2300C~2700C最为有利.为研究合成气最合适的起始组成比,分别在 2300C、2500C和2700C进行实验,结果如图1 所示.则2300C的实验结果所对应的曲线是 (填字母);该温度下工业生产造宜采用的合成气组成n(H2):n(CO)的比值范围是 (填字母).
A.1~1.5B.2.5~3C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0 某温度下,该反应的平衡常数K=1.
①该温度下,若起始时c(CO)=1mol/L,c(H2O)=2mol/L,反应进行一段时间后,测得H2的浓度为0.5mol/L,则此时该反应v(正) v(逆) (填>、=、<).
②若降低温度,该反应的K值将 .(填“增大“、“减小“或“不变“)
(4)某研究小组设计了如图2所示的甲醇燃料电池装置.
①该电池工作时,OH-向 极移动(填“a“或‘'b“).
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为 .

(1)已知:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.0kJ/mol
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
(2)工业上常利用反应CO(g)+2H2(g)=CH3OH(g)△H<0合成甲醇,在2300C~2700C最为有利.为研究合成气最合适的起始组成比,分别在 2300C、2500C和2700C进行实验,结果如图1 所示.则2300C的实验结果所对应的曲线是
A.1~1.5B.2.5~3C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0 某温度下,该反应的平衡常数K=1.
①该温度下,若起始时c(CO)=1mol/L,c(H2O)=2mol/L,反应进行一段时间后,测得H2的浓度为0.5mol/L,则此时该反应v(正)
②若降低温度,该反应的K值将
(4)某研究小组设计了如图2所示的甲醇燃料电池装置.
①该电池工作时,OH-向
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算分析得到所需热化学方程式;
(2)依据反应是放热反应,温度越高,反应物转化率越小来回答,反应的配比依据合成氨的工业制备原理类推;
(3)①依据化学三段式列式计算,结合浓度商和平衡常数比较判断反应进行的方向;
②反应是放热反应,降低温度平衡正向进行;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
②电池反应为甲醇和氧气反应生成碳酸钾、水,结合电荷守恒书写离子方程式;
(2)依据反应是放热反应,温度越高,反应物转化率越小来回答,反应的配比依据合成氨的工业制备原理类推;
(3)①依据化学三段式列式计算,结合浓度商和平衡常数比较判断反应进行的方向;
②反应是放热反应,降低温度平衡正向进行;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
②电池反应为甲醇和氧气反应生成碳酸钾、水,结合电荷守恒书写离子方程式;
解答:
解:(1)①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.0kJ/mol
依据盖斯定律计算(②-①×2)×
CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ/mol;
(2)工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图.合成甲醇是放热反应,温度越低转化率越大,结合图象可知,230℃的实验结果所对应的曲线是 X,;工业生产适宜采用的合成气组成比n(H2):n(CO)的范围应反应中 一氧化碳的转化率大,提高氢气的量会提高一氧化碳的转化率,所以n(H2):n(CO)>2:1,选项中氢气量过量多消耗原料,故选B.
故答案为:X,B;
(3)①若起始时c(CO)=1mol/L,c(H2O)=2mol/L,反应进行一段时间后,测得H2的浓度为0.5mol/L
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.5 0.5 0.5 0.5
某时刻(mol/L) 1.5 0.5 0.5 0.5
Qc=
=
<K=1,反应正向进行,此时该反应v(正)>v(逆);
故答案为:>;
②H2O(g)+CO(g)?H2(g)+CO2(g)△H<0,反应是放热反应,降低温度,平衡正向进行,该反应的K值将增大;
故答案为:增大;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
故答案为:b;
②电池反应为甲醇和氧气反应生成碳酸钾、水,反应的离子方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.0kJ/mol
依据盖斯定律计算(②-①×2)×
| 1 |
| 2 |
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ/mol;
(2)工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图.合成甲醇是放热反应,温度越低转化率越大,结合图象可知,230℃的实验结果所对应的曲线是 X,;工业生产适宜采用的合成气组成比n(H2):n(CO)的范围应反应中 一氧化碳的转化率大,提高氢气的量会提高一氧化碳的转化率,所以n(H2):n(CO)>2:1,选项中氢气量过量多消耗原料,故选B.
故答案为:X,B;
(3)①若起始时c(CO)=1mol/L,c(H2O)=2mol/L,反应进行一段时间后,测得H2的浓度为0.5mol/L
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.5 0.5 0.5 0.5
某时刻(mol/L) 1.5 0.5 0.5 0.5
Qc=
| 0.5×0.5 |
| 1.5×0.5 |
| 1 |
| 3 |
故答案为:>;
②H2O(g)+CO(g)?H2(g)+CO2(g)△H<0,反应是放热反应,降低温度,平衡正向进行,该反应的K值将增大;
故答案为:增大;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
故答案为:b;
②电池反应为甲醇和氧气反应生成碳酸钾、水,反应的离子方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
点评:本题考查了热化学方程式和盖斯定律计算应用,化学平衡常数、化学平衡影响因素分析判断,原电池原理的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
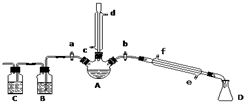 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
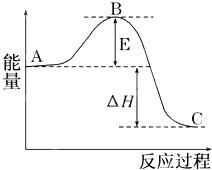 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.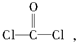 每个COCl2分子内含有
每个COCl2分子内含有 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.