题目内容
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯该粗盐的流程如下:粗盐溶解
| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3液 c.NaOH溶液 d.BaCL2溶液 e.Ba(NO3)2溶液
①欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,需依次加入三种试剂,顺序依次为
②蒸发操作即将结束,当
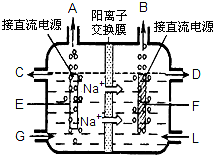
(2)食盐是工业上生产氯气和烧碱的重要原料.如图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成(惰性电极),阴极由碳钢网制成(含C.Fe)).
①F电极是
②如果采用无膜电解槽,开始时将直流电源的正负极与电极接反了,通电几分钟,在电极F附近可以观察到的现象是
(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液.实验室在常温下电解饱和食盐水,当收集到22.4L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量最多为
考点:粗盐提纯,电解原理
专题:实验设计题,电化学专题
分析:(1)①把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
②玻璃棒搅拌,当溶液中有大量晶体析出时,停止加热,熄灭酒精灯;
(2)①工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气;
②将直流电源的正负极与电极接反,E极为阴极,F为阳极;
(3)每生成1mol氢气生成1mol氯气和2mol氢氧根离子,1mol氯气和2mol氢氧根离子反应生成1mol次氯酸钠.
②玻璃棒搅拌,当溶液中有大量晶体析出时,停止加热,熄灭酒精灯;
(2)①工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气;
②将直流电源的正负极与电极接反,E极为阴极,F为阳极;
(3)每生成1mol氢气生成1mol氯气和2mol氢氧根离子,1mol氯气和2mol氢氧根离子反应生成1mol次氯酸钠.
解答:
解:(1)①除去粗盐中的可溶性杂质:Mg2+、Ca2+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,故答案为:d c a(或d a c,或c d a);
②玻璃棒搅拌使受热均匀,当溶液中有大量晶体析出时,停止加热,熄灭酒精灯,故答案为:溶液中有大量晶体析出;
(2)①工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气,G处进口的物质是精制的饱和食盐水,离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:阴极;精制的饱和食盐水;2Cl-+2H2O
Cl2↑+H2↑+2OH-;
②E极为阴极,F为阳极,在阳极上活泼金属失电子,铁失电子生成二价铁离子,在阴极上氢离子得电子生成氢气,氢氧根浓度增大,生成氢氧化铁,氢氧化铁易被氧化,
故答案为:溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀;
(3)根据方程式2Cl-+2H2O
Cl2↑+H2↑+2OH-,可知当收集到22.4L即1mol标准状况下的H2,1mol氯气和2mol氢氧根离子反应生成1mol次氯酸钠,即反应生成1mol次氯酸钠,生成次氯酸钠的质量为1mol×74.5g/mol=74.5g,故答案为:74.5g.
②玻璃棒搅拌使受热均匀,当溶液中有大量晶体析出时,停止加热,熄灭酒精灯,故答案为:溶液中有大量晶体析出;
(2)①工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气,G处进口的物质是精制的饱和食盐水,离子方程式为:2Cl-+2H2O
| ||
| ||
②E极为阴极,F为阳极,在阳极上活泼金属失电子,铁失电子生成二价铁离子,在阴极上氢离子得电子生成氢气,氢氧根浓度增大,生成氢氧化铁,氢氧化铁易被氧化,
故答案为:溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀;
(3)根据方程式2Cl-+2H2O
| ||
点评:本题考查粗盐提纯和质量分数计算等,明确有关的反应是解题的关键,题目难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
t℃时,在体积不变的容器巾发生反应:X(g)+3Y(g)?2Z(g)△H<0各组分浓度如下表:
下列说法不正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.3 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | ||
| 平衡浓度/mol?L-1 | 0.1 |
| A、0~2min的平均速率v(X)=0.01mol?L-1?min-1 |
| B、达平衡时Y的转化率为50% |
| C、其它条件不变,升高温度,平衡逆向移动 |
| D、其它条件不变,增加X的浓度,v正增大v逆减小,平衡正向移动 |
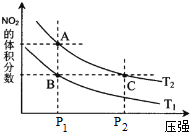
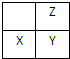 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |
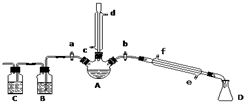 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
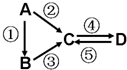 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
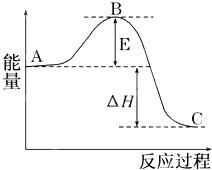 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.