题目内容
汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题.
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)?2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H= (用△H1、△H2、△H3表达)
(2)在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是 (填字母)
A.NO的生成速率与NO的消耗速率相等
B.v(CO)=v(CO2)
C.体系的压强保持不变
D.各物质的浓度保持不变
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①写出该反应的平衡常数表达式:K= .
②30min后,改变某一条件,平衡发生了移动,则改变的条件是 ;若升高温度,NO浓度将 (填“增大”、“不变”或“减小”).
③计算从0~20min内,NO的平均反应速率.(写出计算过程) .
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)?2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=
(2)在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是
A.NO的生成速率与NO的消耗速率相等
B.v(CO)=v(CO2)
C.体系的压强保持不变
D.各物质的浓度保持不变
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,平衡发生了移动,则改变的条件是
③计算从0~20min内,NO的平均反应速率.(写出计算过程)
考点:热化学方程式,化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)依据平衡标志是正逆反应速率相同,各成分含量保持不变,据此分析选项;
(3)①依据反应化学方程式,结合平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质;反应是吸热反应,升温平衡正向进行;
③依据化学反应速率概念计算得到,v=
计算得到.
(2)依据平衡标志是正逆反应速率相同,各成分含量保持不变,据此分析选项;
(3)①依据反应化学方程式,结合平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质;反应是吸热反应,升温平衡正向进行;
③依据化学反应速率概念计算得到,v=
| △c |
| △t |
解答:
解:(1)已知:①N2(g)+O2(g)═2NO(g)△H1
②N2(g)+3H2(g)?2NH3(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
依据盖斯定律3×③-①×2-②×2得到热化学方程式为:4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(3△H3-2△H1-2△H2)KJ/mol;
故答案为:3△H3-2△H1-2△H2 ;
(2)2NO(g)+2CO(g)?N2(g)+2CO2(g),反应是气体体积减小的反应
A.NO的生成速率与NO的消耗速率相等是平衡标志,故A正确;
B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v(CO)=v(CO2)不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量变化,体系的压强保持不变说明反应达到平衡状态,故C正确;
D.各物质的浓度保持不变是平衡标志,故D正确;
故选B.
(3)①C(s)+2NO(g)?N2(g)+CO2(g)△H>0,固体不写入平衡常数表达式,平衡常数K=
;
故答案为:
;
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,反应是吸热反应,升温平衡正向进行,一氧化氮浓度减小;
故答案为:减少CO2浓度;
③从0~20min内,NO的平均反应速率v=
=0.003mol/L?min;
故答案为:0.003mol/L?min.
②N2(g)+3H2(g)?2NH3(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
依据盖斯定律3×③-①×2-②×2得到热化学方程式为:4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(3△H3-2△H1-2△H2)KJ/mol;
故答案为:3△H3-2△H1-2△H2 ;
(2)2NO(g)+2CO(g)?N2(g)+2CO2(g),反应是气体体积减小的反应
A.NO的生成速率与NO的消耗速率相等是平衡标志,故A正确;
B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v(CO)=v(CO2)不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量变化,体系的压强保持不变说明反应达到平衡状态,故C正确;
D.各物质的浓度保持不变是平衡标志,故D正确;
故选B.
(3)①C(s)+2NO(g)?N2(g)+CO2(g)△H>0,固体不写入平衡常数表达式,平衡常数K=
| c(CO2)×c(N2) |
| c2(NO) |
故答案为:
| c(CO2)×c(N2) |
| c2(NO) |
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,反应是吸热反应,升温平衡正向进行,一氧化氮浓度减小;
故答案为:减少CO2浓度;
③从0~20min内,NO的平均反应速率v=
| 0.100mol/L-0.04mol/L |
| 20min |
故答案为:0.003mol/L?min.
点评:本题考查了热化学 方程式和盖斯定律计算应用,化学平衡标志的理解分析,反应速率,平衡常数计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
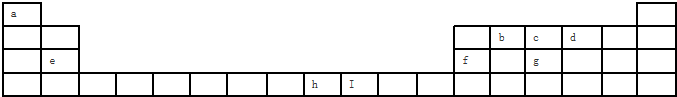
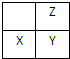 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |
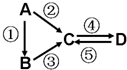 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
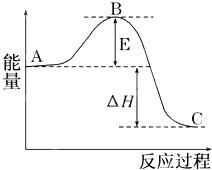 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.