题目内容
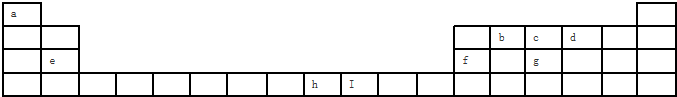
如图是元素周期表的一部分,表中所列字母分别代表某一化学元素.用化学用语回答下列问题.

(1)d、e、f的离子半径由大到小的顺序为 .b、c、g的最高价含氧酸的酸性由强到弱的顺序为 ,a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为 .
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 .实验室制取i单质的化学方程式为 .
(3)呈两性的氢氧化物是溶于强碱的离子方程式为 .
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 ,它与h的低价态氧化物反应的化学方程式为 .

(1)d、e、f的离子半径由大到小的顺序为
(2)i元素的最高价氧化物对应的水化物为
(3)呈两性的氢氧化物是溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Na、f为Al、g为Si、h为S、i为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;非金属性越强,最高价含氧酸的酸性越强,氢化物越稳定;
(2)i元素的最高价氧化物对应的水化物为高氯酸,e的最高价氧化物对应水化物为氢氧化钠,二者反应生成高氯酸钠与水,实验室制取用二氧化锰与浓盐酸在加热条件下制备氯气;
(3)氢氧化铝属于两性氢氧化物,与强碱反应生成偏铝酸盐与水;
(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键、共价键;h的低价态氧化物为二氧化硫,与过氧化钠反应生成硫酸钠.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;非金属性越强,最高价含氧酸的酸性越强,氢化物越稳定;
(2)i元素的最高价氧化物对应的水化物为高氯酸,e的最高价氧化物对应水化物为氢氧化钠,二者反应生成高氯酸钠与水,实验室制取用二氧化锰与浓盐酸在加热条件下制备氯气;
(3)氢氧化铝属于两性氢氧化物,与强碱反应生成偏铝酸盐与水;
(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键、共价键;h的低价态氧化物为二氧化硫,与过氧化钠反应生成硫酸钠.
解答:
解:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Na、f为Al、g为Si、h为S、i为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:O2->Na+>Al3+;非金属性N>C>Si,故酸性:HNO3>H2CO3>H2SiO3,非金属Cl>S>Si,故氢化物稳定性:HCl>H2S>SiH4,
故答案为:O2->Na+>Al3+;HNO3>H2CO3>H2SiO3;HCl>H2S>SiH4;
(2)i元素的最高价氧化物对应的水化物为高氯酸,化学式为HClO4,e的最高价氧化物对应水化物为氢氧化钠,二者反应生成高氯酸钠与水,离子方程式为:OH-+H+=H2O,实验室制取用二氧化锰与浓盐酸在加热条件下制备氯气,反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:HClO4;OH-+H+=H2O;OH-+H+=H2O;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(3)氢氧化铝属于两性氢氧化物,与强碱反应生成偏铝酸盐与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键、共价键;h的低价态氧化物为二氧化硫,与过氧化钠反应生成硫酸钠,反应方程式为:Na2O2+SO2=Na2SO4,
故答案为:离子键、共价键;Na2O2+SO2=Na2SO4.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:O2->Na+>Al3+;非金属性N>C>Si,故酸性:HNO3>H2CO3>H2SiO3,非金属Cl>S>Si,故氢化物稳定性:HCl>H2S>SiH4,
故答案为:O2->Na+>Al3+;HNO3>H2CO3>H2SiO3;HCl>H2S>SiH4;
(2)i元素的最高价氧化物对应的水化物为高氯酸,化学式为HClO4,e的最高价氧化物对应水化物为氢氧化钠,二者反应生成高氯酸钠与水,离子方程式为:OH-+H+=H2O,实验室制取用二氧化锰与浓盐酸在加热条件下制备氯气,反应方程式为:MnO2+4HCl(浓)
| ||
故答案为:HClO4;OH-+H+=H2O;OH-+H+=H2O;MnO2+4HCl(浓)
| ||
(3)氢氧化铝属于两性氢氧化物,与强碱反应生成偏铝酸盐与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键、共价键;h的低价态氧化物为二氧化硫,与过氧化钠反应生成硫酸钠,反应方程式为:Na2O2+SO2=Na2SO4,
故答案为:离子键、共价键;Na2O2+SO2=Na2SO4.
点评:本题考查元素周期表与元素周期律综合应用,注意对元素周期律的理解掌握,有利于基础知识的巩固.

练习册系列答案
相关题目
常见金属R与硝酸银溶液反应的化学方程式为R+3AgNO3═3Ag+R(NO3)3,有关该反应的说法正确的是( )
| A、反应后溶液质量一定增加 |
| B、该金属可能是铁 |
| C、R的活泼性比Ag弱 |
| D、R表面有固体析出 |
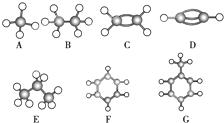 A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
A~G是几种烃的分子球棍模型(如图),据此回答下列问题: