题目内容
3.下列化学用语表示正确的是( )| A. | CO2的电子式为: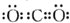 | |
| B. | S2-的离子离子结构示意图是: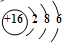 | |
| C. | 原子核内有18个中子的氯原子:3518Cl | |
| D. | HBr电子式为: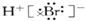 |
分析 A.CO2是共价化合物,其结构式为O=C=O;
B.硫离子最外层含有8个电子;
C.质子数写在左下角,质量数写在左上角;
D.溴化氢为共价化合物,氢原子与溴原子形成了一个共用电子对;
解答 解:A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为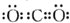 ,故A正确;
,故A正确;
B.硫离子核外存在18个电子,核内有16个质子,最外层达到8电子稳定结构,其离子结构示意图为: ,故B错误;
,故B错误;
C.原子核内有18个中子的氯原子,质子数为17,质量数为35,符号为:3517Cl,故C错误;
D.溴化氢为共价化合物,氢原子与溴原子形成了一个共用电子对,溴化氢中氢原子最外层为2个电子,溴原子最外层达到8电子,用小黑点表示原子最外层电子,则溴化氢的电子式为 ,故D错误;
,故D错误;
故选:A.
点评 本题考查了化学用语,注意掌握常见化学用语的表示方法,该考点是高考考查的热点,本题侧重于对学生基础知识的考查,题目难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
14.0.01mol•L-1H B溶液的pH=2,将溶液稀释100倍后,溶液的pH值可能为( )
| A. | 1 | B. | 4 | C. | 5 | D. | 8 |
11.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)画出原子的结构示意图:④ ,⑧
,⑧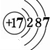 .
.
(3)在上述标出元素中,金属性最强的元素是K,非金属性最强的元素是_F,最不活泼的元素是Ar.(均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.(选填序号)
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是Na(填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是Cl(填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式OH-+H+═H2O
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式:CO2+NaOH═NaHCO3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
 ,⑧
,⑧ .
.(3)在上述标出元素中,金属性最强的元素是K,非金属性最强的元素是_F,最不活泼的元素是Ar.(均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.(选填序号)
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是Na(填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是Cl(填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式OH-+H+═H2O
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式:CO2+NaOH═NaHCO3.
18.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | L、M的单质与稀硫酸反应速率:M>L | |
| C. | T、Q的氢化物常态下均为无色气体 | |
| D. | L、Q形成的简单离子核外电子数相等 |
8.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
| A. | 盐酸的浓度 | B. | 铝条的表面积 | C. | 溶液的温度 | D. | 加少量NaCl固体 |
15.下列各原子或离子的电子排布式错误的是( )
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
 用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:
用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应: