题目内容
12.回答下列问题:(1)氨的水溶液叫做氨水.用离子方程式表示氨水成碱性的原因NH3•H2O?NH4++OH-
(2)实验室制备氨气,下列方法中可以选用的是②③④.
①固态氯化铵加热分解 ②浓氨水中加入固体氢氧化钠
③加热浓氨水 ④固态氯化铵与氢氧化钙混合加热
(3)管道工人曾经用浓氨水检验氯气是否漏气.在有水蒸气存在的条件下能发生反应 2NH3+3Cl2=6HCl+N2
反应中如果有1.7克氨气被氧化,则被还原的氯气体积为3.36L(标准状况下)
如果氯气管道漏气,用该方法检验时的现象是产生大量白烟
(4)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸氨催化氧化额化学方程式为4NH3+5O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O,将铂铑合金做成薄丝网的主要原因是增大单位质量的催化剂与反应物的接触面积.
分析 (1)氨水中含有一水合氨,一水合氨部分电离生成铵根离子与氢氧根离子,溶液呈碱性;
(2)①氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵;
②氢氧化钠溶于水放热,同时电离生成氢氧根离子;
③加热浓氨水,NH3+H2O?NH3•H2O?NH4++OH-,平衡向逆反应方向移动;
④熟石灰和氯化铵混合后加热生成氨气、氯化钙和水;
(3)依据方程式2NH3+3Cl2=6HCl+N2,可知2mol氨气被氧化,有3mol氯气被还原;
氨气与氯化氢反应生成氯化铵白色固体;
(4)氨气催化氧化生成氮气和水;氨的催化氧化的催化剂是将铂铑合金做成薄丝网,这样能增大单位质量的催化剂与反应物的接触面积;
解答 解:(1)氨水中含有一水合氨,一水合氨部分电离生成铵根离子与氢氧根离子,电离方程式;NH3•H2O?NH4++OH-,所以氨水显碱性;
故答案为:NH3•H2O?NH4++OH-;
(2)①氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气,故A不选;
②NH3+H2O?NH3•H2O?NH4++OH-,氢氧化钠溶于水放热,同时电离生成氢氧根离子,依据平衡移动理论可知,放热、碱性环境下有利于氨气的逸出,可以制取氨气,故②选;
③氨水中存在平衡关系:NH3+H2O═NH3•H2O═NH4++OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可以制取氨气,故③选;
④熟石灰和氯化铵混合后加热可以制取氨气,故④选;
故答案为:②③④;
(3)依据方程式2NH3+3Cl2=6HCl+N2,可知2mol氨气被氧化,有3mol氯气被还原,则:如果有1.7克氨气,物质的量为$\frac{1.7g}{17g/mol}$=0.1mol,则被氧化的氯气物质的量为0.15mol,标况下体积为:0.15mol×22.4L/mol=3.36L;
氨气与氯化氢反应生成氯化铵白色固体,所以如果氨气氯气泄漏会产生大量白烟;
故答案为:3.36;产生大量白烟;
(4)氨气催化氧化生成氮气和水,化学方程式:4NH3+5O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;氨的催化氧化的催化剂是将铂铑合金做成薄丝网,这样能增大单位质量的催化剂与反应物的接触面积;
故答案为:4NH3+5O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;增大单位质量的催化剂与反应物的接触面积.
点评 本题考查了氨气的实验室制备和性质,熟悉氨气制备原理及性质是解题关键,题目难度不大.

| A. | CO2的电子式为: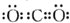 | |
| B. | S2-的离子离子结构示意图是: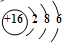 | |
| C. | 原子核内有18个中子的氯原子:3518Cl | |
| D. | HBr电子式为: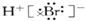 |
| A. | 有氧化性,无还原性,无酸性 | B. | 无氧化性,有还原性,无酸性 | ||
| C. | 有氧化性,有还原性,有酸性 | D. | 无氧化性,有还原性,有酸性 |
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | K2O的电子式: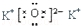 | |
| C. | 2-乙基-1,3-丁二烯分子的键线式: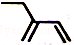 | |
| D. | 比例模型  可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
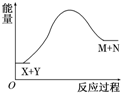
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
| A. | 原子半径:X>Y>Z | |
| B. | 阴离子的还原性:W>X>Y | |
| C. | 气态氢化物的沸点:Y<W | |
| D. | 元素X与Z形成的两种化合物中,X的化合价相同 |
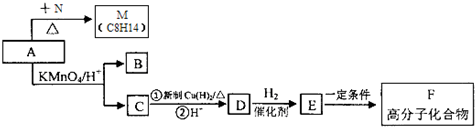
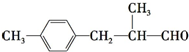
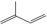 ,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构).
,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构). .
.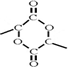 含有三元环:
含有三元环: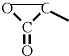 .
.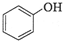
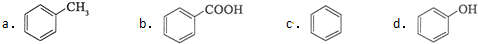
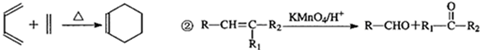
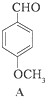 $→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$
$→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$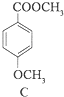
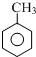 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$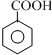
 .
.