题目内容
11.下表是元素周期表的一部分,回答下列有关问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
 ,⑧
,⑧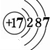 .
.(3)在上述标出元素中,金属性最强的元素是K,非金属性最强的元素是_F,最不活泼的元素是Ar.(均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.(选填序号)
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是Na(填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是Cl(填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式OH-+H+═H2O
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式:CO2+NaOH═NaHCO3.
分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,⑪为Ca,⑫为Br,然后利用元素及其单质、化合物的性质来解答.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,⑪为Ca,⑫为Br,
(1)由上述分析可知①为N,⑥为Si,⑦为S,故答案为:N;Si;S;
(2)④Mg的原子结构示意图为 ,⑧的原子结构示意图为
,⑧的原子结构示意图为 ,
,
故答案为: ;
; ;
;
(3)以上元素中金属性最强的是K,非金属性最强的是F,Ar的最外层电子数为8,则Ar最不活泼,故答案为:K;F;Ar;
(4)⑦为S,⑧为Cl,同周期元素从左向右元素的非金属增强,则Cl的非金属性强,可利用气态氢化物的稳定性来验证,二者的状态及与碱的反应不能说明,
故答案为:Cl;b;
(5)第三周期从左向右原子半径在减小,则Na的原子半径最大,原子半径最小的为Cl,它们最高价氧化物对应水化物之间反应的离子方程式为OH-+H+═H2O,
故答案为:Na;Cl;OH-+H+═H2O;
(6)某元素原子最外层电子数是其次外层电子数的2倍,为C元素,足量该元素的常见氧化物二氧化碳通入③的最高价氧化物的水化物NaOH的溶液中的化学反应方程式为CO2+NaOH═NaHCO3,故答案为:CO2+NaOH═NaHCO3.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质及元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
19.如图为离子晶体空间构型示意图,则离子晶体的组成表达式不正确的是( )


| A. | XY | B. | XY2Z | C. | XY3 | D. | XY2 |
6.2016年4月16日凌晨日本南部九州地区发生的7.3级地震,九州阿苏地区发生了大规模山体滑坡及火山爆发,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为( )
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
3.下列化学用语表示正确的是( )
| A. | CO2的电子式为: | |
| B. | S2-的离子离子结构示意图是: | |
| C. | 原子核内有18个中子的氯原子:3518Cl | |
| D. | HBr电子式为: |
20.SO2溶于水所得溶液的性质为( )
| A. | 有氧化性,无还原性,无酸性 | B. | 无氧化性,有还原性,无酸性 | ||
| C. | 有氧化性,有还原性,有酸性 | D. | 无氧化性,有还原性,有酸性 |
1.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子数的3倍,Z是同周期中金属性最强的元素,W与X同主族.下列说法正确的是( )
| A. | 原子半径:X>Y>Z | |
| B. | 阴离子的还原性:W>X>Y | |
| C. | 气态氢化物的沸点:Y<W | |
| D. | 元素X与Z形成的两种化合物中,X的化合价相同 |