题目内容
15.下列各原子或离子的电子排布式错误的是( )| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
分析 由低能级逐步填充到高能级,能级能量为:3d>4s>3p>3s>2p>2s>1s,ns<(n-2)f<(n-1)d<np (n表示能层序数),s、p、d、f能级最多可容纳电子数依次为2、6、10、14,注意洪特规则特例.
解答 解:A.Na元素原子核外有11个电子,失去一个电子生成Na+,Na+的电子排布式为1s22s22p6,故A正确;
B.F电子排布式为1s22s22p5,符合能量最低原理,故B正确;
C.Cl-电子排布式为1s22s22p63s23p6,选项中为氯原子核外电子排布式,故C错误;
D.Mn原子核外电子数为25,电子排布式为1s22s22p63s23p63d54s2,符合能量最低原理,故D正确.
故选:C.
点评 本题考查核外电子排布规律,核外电子排布应符合构造原理、能量最低原理、洪特规则和泡利不相容原理.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
5.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5.
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈暗红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈暗红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
6.2016年4月16日凌晨日本南部九州地区发生的7.3级地震,九州阿苏地区发生了大规模山体滑坡及火山爆发,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为( )
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
3.下列化学用语表示正确的是( )
| A. | CO2的电子式为: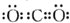 | |
| B. | S2-的离子离子结构示意图是: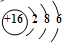 | |
| C. | 原子核内有18个中子的氯原子:3518Cl | |
| D. | HBr电子式为: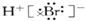 |
20.SO2溶于水所得溶液的性质为( )
| A. | 有氧化性,无还原性,无酸性 | B. | 无氧化性,有还原性,无酸性 | ||
| C. | 有氧化性,有还原性,有酸性 | D. | 无氧化性,有还原性,有酸性 |
7.下列化学用语描述中不正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | K2O的电子式: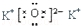 | |
| C. | 2-乙基-1,3-丁二烯分子的键线式: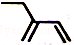 | |
| D. | 比例模型  可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
4.已知X+Y═M+N反应中的能量变化过程如图,则下列有关说法正确的是( )
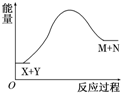

| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |

 .
.  .
. .
.