题目内容
某温度时有精制的食盐水700克,其中含食盐160克,充分电解该食盐水,试通过计算:
(1)当逸出的氯气在标准状况下体积为28L时,生成的氢氧化钠的物质的量为多少?氢氧化钠的质量分数是多少?
(2)若上述气体28L氯气通入含370克氢氧化钙的石灰乳,充分反应后理论上克得到次氯酸钙多少克?
(1)当逸出的氯气在标准状况下体积为28L时,生成的氢氧化钠的物质的量为多少?氢氧化钠的质量分数是多少?
(2)若上述气体28L氯气通入含370克氢氧化钙的石灰乳,充分反应后理论上克得到次氯酸钙多少克?
考点:溶液中溶质的质量分数及相关计算
专题:计算题
分析:(1)根据n=
计算出氯气的物质的量,然后根据反应方程式分别计算出生成氢气、氢氧化钠的物质的量,再根据溶质质量分数的表达式计算出氢氧化钠的质量分数;
(2)根据n=
计算出氢氧化钙的物质的量,再根据反应方程式判断过量,根据不足量计算出生成次氯酸钙的质量.
| V |
| Vm |
(2)根据n=
| m |
| M |
解答:
解:(1)标准状况下28L氯气的物质的量为:n(Cl2)=
=1.25mol,根据反应方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑可知,生成氢氧化钠的物质的量为:n(NaOH)=2n(Cl2)=1.25mol×2=2.5mol,反应生成氢气的物质的量为:n(H2)=n(Cl2)=1.25mol,
则电解后的溶液中氢氧化钠的质量分数为:ω(NaOH)=
×100%≈16.4%,
答:生成氢氧化钠的物质的量为2.5mol;氢氧化钠的质量分数为16.4%;
(2)370g氢氧化钙的物质的量为:n(Ca(OH)2)=
=5mol,
标准状况下28L氯气的物质的量为:n(Cl2)=
=1.25mol,
根据反应方程式2Cl2+2Ca(OH)2═CaCl2+2H2O+Ca(ClO)2可知,氯气不足,反应生成次氯酸钙的物质的量为:n[Ca(ClO)2]=
n(Cl2)=0.625mol,
所以生成次氯酸钙的质量为:143g/mol×0.625mol=89.375g,
答:充分反应后理论上克得到次氯酸钙89.375g.
| 28L |
| 22.4L/mol |
| ||
则电解后的溶液中氢氧化钠的质量分数为:ω(NaOH)=
| 40g/mol×2.5mol |
| 700g-71g/mol×1.25mol-2g/mol×1.25mol |
答:生成氢氧化钠的物质的量为2.5mol;氢氧化钠的质量分数为16.4%;
(2)370g氢氧化钙的物质的量为:n(Ca(OH)2)=
| 370g |
| 74g/mol |
标准状况下28L氯气的物质的量为:n(Cl2)=
| 28L |
| 22.4L/mol |
根据反应方程式2Cl2+2Ca(OH)2═CaCl2+2H2O+Ca(ClO)2可知,氯气不足,反应生成次氯酸钙的物质的量为:n[Ca(ClO)2]=
| 1 |
| 2 |
所以生成次氯酸钙的质量为:143g/mol×0.625mol=89.375g,
答:充分反应后理论上克得到次氯酸钙89.375g.
点评:本题考查了有关化学方程式的计算、溶质质量分数的计算,题目难度中等,注意掌握溶质质量分数的概念及表达式,明确反应原理为解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理、操作规范的是( )
A、 灼烧 |
B、 过滤 |
C、 分液 |
D、 蒸馏 |
下列物质的性质、用途正确的是( )
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、Na2SiO3是制备硅胶和木材防火剂的原料 |
| C、明矾和漂白粉常用于自来水的净化,两者的作用原理完全相同 |
| D、合金的硬度比纯金属大,熔点也比纯金属高 |
已知298K时,Mg(OH)2的容度积常数KKsp=5.6×10-12,MgCO3容度积常数KKsp=6.8×10-6,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A、298K时在水中溶解能力Mg(OH)2弱于MgCO3 |
| B、MgCO3悬浊液中加入适量的烧碱溶液可以生成Mg(OH)2沉淀 |
| C、沉淀溶解平衡时溶液中的c(Mg2+)=5.6×10-10mol?L-1 |
| D、298时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)大 |
 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: A、B、C、D、E为周期表中前四周期的元素,其核电荷数依次增大,A、B、C为同一周期元素,AC与B2互为等电子体,D原子中s电子总数与p电子总数相等,且与B能形成离子化合物D3B2,五种元素的核电荷数之和为62.请回答下列问题:
A、B、C、D、E为周期表中前四周期的元素,其核电荷数依次增大,A、B、C为同一周期元素,AC与B2互为等电子体,D原子中s电子总数与p电子总数相等,且与B能形成离子化合物D3B2,五种元素的核电荷数之和为62.请回答下列问题: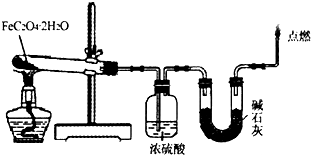 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题