题目内容
实验室里用乙醇和浓硫酸反应生成乙烯,再用溴与乙烯反应生成1,2-二溴乙烷,可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:
(1)用下列仪器制备1,2-二溴乙烷.如果气体流向为从左到右,则正确的连接顺序是(短接口或橡皮管均已略去): 经A(1)插入A中, 接A(2),A(3)接 接 接 接 (填大写字母代号).
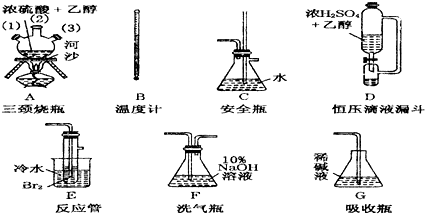
(2)温度计水银球的正确位置是 .
a、支管口处 b、液面上方 c、液面以下
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中水,振荡后静置,产物应在 层(填“上”“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a、水 b、氢氧化钠溶液 c、碘化钠溶液 d、乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置E,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 .
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |

(2)温度计水银球的正确位置是
a、支管口处 b、液面上方 c、液面以下
(3)判断该制备反应已经结束的最简单方法是
(4)将1,2-二溴乙烷粗产品置于分液漏斗中水,振荡后静置,产物应在
(5)若产物中有少量未反应的Br2,最好用
a、水 b、氢氧化钠溶液 c、碘化钠溶液 d、乙醇
(6)若产物中有少量副产物乙醚,可用
(7)反应过程中应用冷水冷却装置E,其主要目的是
考点:乙醇的消去反应,溴乙烷的制取
专题:实验题,有机物的化学性质及推断
分析:(1)制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”;
(2)根据温度计在实验中的作用判断温度计水银球的位置;
(3)溴与乙烯发生加成反应使溴单质褪色,可以据此判断反应是否结束;
(4)1,2-二溴乙烷的密度大于水,据此判断其在分液漏斗中的位置;
(5)溴单质能够与氢氧化钠溶液反应生成溴化钠、次溴酸钠和水,除杂试剂能够除去杂质,不能引进新的杂质;
(6)乙醚与1,2-二溴乙烷互溶,可以根据二者沸点相差较大提高蒸馏操作分离;
(7)根据溴单质沸点较低、容易挥发判断;根据1,2-二溴乙烷的熔点较低进行解答.
(2)根据温度计在实验中的作用判断温度计水银球的位置;
(3)溴与乙烯发生加成反应使溴单质褪色,可以据此判断反应是否结束;
(4)1,2-二溴乙烷的密度大于水,据此判断其在分液漏斗中的位置;
(5)溴单质能够与氢氧化钠溶液反应生成溴化钠、次溴酸钠和水,除杂试剂能够除去杂质,不能引进新的杂质;
(6)乙醚与1,2-二溴乙烷互溶,可以根据二者沸点相差较大提高蒸馏操作分离;
(7)根据溴单质沸点较低、容易挥发判断;根据1,2-二溴乙烷的熔点较低进行解答.
解答:
解:(1)仪器组装顺序是:制取乙烯气体(用A接A(1)、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”,
故答案为:B D C F E G;
(2)乙醇在浓硫酸作用下加热到1700C时发消去反应生成乙烯,则温度计的位置应插入三颈烧瓶的液体中,所以c正确,
故答案为:c;
(3)乙烯中含有碳碳双键,能够与溴发生加成反应,从而导致溴褪色,所以可通过装置E中溴的颜色完全褪去,判断反应已经结束,
故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷的密度大于水,则在分液漏斗中混合液的下层,
故答案为:下;
(5)单质溴能够与氢氧化钠溶液反应生成溴化钠、次溴酸钠和水,可以用氢氧化钠溶液吸收未反应的溴,而溴在水中溶解度较小、溴与碘化钠反应生成了新的杂质碘单质、乙醇能够溶解1,2-二溴乙烷,所以正确的为b,
故答案为:b;
(6)乙醚和1,2-二溴乙烷相互溶解,根据表中数据可知,乙醚和1,2-二溴乙烷的沸点相差较大,可以通过蒸馏方法分离出杂质乙醚,
故答案为:蒸馏;
(7)溴易挥发,为减少挥发,在反应管E中加入少量水可起到水封的作用,把反应管E置于盛有冷水的小烧杯中,可降低温度,减少挥发;
由于1,2-二溴乙烷的熔点为9℃,温度降低1,2-二溴乙烷会凝固导致堵塞导管,所以温度不能过低,
故答案为:减少溴的挥发损失;产品1,2二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
故答案为:B D C F E G;
(2)乙醇在浓硫酸作用下加热到1700C时发消去反应生成乙烯,则温度计的位置应插入三颈烧瓶的液体中,所以c正确,
故答案为:c;
(3)乙烯中含有碳碳双键,能够与溴发生加成反应,从而导致溴褪色,所以可通过装置E中溴的颜色完全褪去,判断反应已经结束,
故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷的密度大于水,则在分液漏斗中混合液的下层,
故答案为:下;
(5)单质溴能够与氢氧化钠溶液反应生成溴化钠、次溴酸钠和水,可以用氢氧化钠溶液吸收未反应的溴,而溴在水中溶解度较小、溴与碘化钠反应生成了新的杂质碘单质、乙醇能够溶解1,2-二溴乙烷,所以正确的为b,
故答案为:b;
(6)乙醚和1,2-二溴乙烷相互溶解,根据表中数据可知,乙醚和1,2-二溴乙烷的沸点相差较大,可以通过蒸馏方法分离出杂质乙醚,
故答案为:蒸馏;
(7)溴易挥发,为减少挥发,在反应管E中加入少量水可起到水封的作用,把反应管E置于盛有冷水的小烧杯中,可降低温度,减少挥发;
由于1,2-二溴乙烷的熔点为9℃,温度降低1,2-二溴乙烷会凝固导致堵塞导管,所以温度不能过低,
故答案为:减少溴的挥发损失;产品1,2二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
点评:本题考查有机物的合成实验设计,题目难度中等,解答本题的关键是把握制备实验的原理,能正确设计实验顺序,牢固把握实验基本操作时解答该类题目的保证,学习中注意加强相关知识的全面学习.

练习册系列答案
相关题目
在常温下,PH=a的醋酸和PH=14-a的NaOH溶液等体积混合,所得溶液的下列说法正确的是( )
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.30×10-5mol/L.若在5mL含有KCl和KI浓度均为0.01mol/L的混合溶液中,滴加8mL 0.01mol/L的AgNO3溶液,则下列叙述中不正确的是A( )
| A、反应后溶液中离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B、发生反应生成的AgI沉淀多于AgCl沉淀 |
| C、在水中AgCl的溶解度比AgI的溶解度大 |
| D、若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.