题目内容
19.如表是稀硫酸与金属镁反应的实验数据:| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).
分析 (1)固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率降低;
(2)反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;
(3)反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低;
(4)从金属消失的时间可知实验5最快,根据v=$\frac{△c}{△t}$计算.
解答 解:(1)观察实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快,
故答案为:固体反应物的表面积;表面积越大;1、2;
(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,2为粉末,5也是粉末状,并且浓度不同,其他条件相同,
故答案为:5;
(3)本实验中,反应温度也影响化学反应速率,要温度不同,其他条件相同,如6和7或8和9;
故答案为:反应温度;7;9;
(4)从金属消失的时间可知实验5最快;反应时间为25s,硫酸开始的浓度为0.8mol•L-1,体积为100mL,物质的量为0.08mol,镁的质量为0.24g,物质的量为0.01mol,根据关系式:Mg~H2SO4可知硫酸过量,硫酸改变的物质的为0.01mol,所以浓度的改变为:$\frac{0.01mol}{0.1L}$=0.1mol•L-1,所以v=$\frac{△c}{△t}$=$\frac{0.1mol•{L}^{-1}}{25s}$=0.004mol/(L•s),
故答案为:5;0.004mol/(L•s).
点评 本题考查影响化学反应速率的因素,注意对比实验,控制变量很重要,化学反应速率的计算是常考点,注意计算的准确性,题目难度适中.

| A. | 二氧化硫具有较强的还原性,故不能用浓硫酸干燥 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应 | |
| D. | FeCl3溶液可以腐蚀线路板上的Cu,不能说明Cu的金属活动性大于Fe |
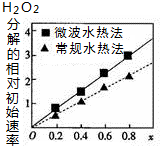 已知CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性,通常由两种不同方法制得.如图为二种方法制得的催化剂,在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线图.下列说法错误的是( )
已知CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性,通常由两种不同方法制得.如图为二种方法制得的催化剂,在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线图.下列说法错误的是( )| A. | 该催化剂中铁元素的化合价为+3价 | |
| B. | Co、Ni、Fe均为ⅧB族元素 | |
| C. | 由图中信息可知,Co2+、Ni2+两种离子中催化效果较好的是Co2+ | |
| D. | 由图中信息可知,微波水热法制取的催化剂活性更高 |
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
(2)已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色.针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入B(填字母序号)做对比实验.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
 (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.| 实验 序号 | 消耗0.1000mol•L-1的 盐酸溶液的体积/mL | 待测氢氧化钠 溶液的体积/mL |
| 1 | 29.02 | 25.00 |
| 2 | 28.01 | 25.00 |
| 3 | 27.99 | 25.00 |
(2)用0.1000mol•L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是0.1120mol•L-1.在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将偏高(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是AC(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
| A. | O2是还原产物 | B. | Na2O2是氧化剂,水是还原剂 | ||
| C. | NaOH是氧化产物 | D. | Na2O2中,氧既得电子,又失电子 |
| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 纯铁易被腐蚀,可以在纯铁中混入碳元素制成“生铁”,以提高其抗腐蚀能力 | |
| D. | 光纤通信是现代化的通信手段,光导纤维的主要成分是晶体硅 |
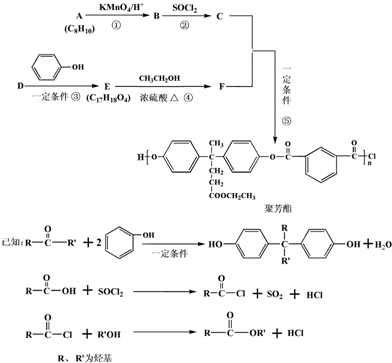
 .
. .
.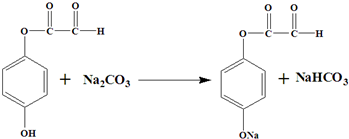 或
或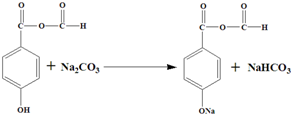 .
.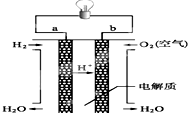 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.