题目内容
9.化学在生活中发挥着重要的作用,下列说法正确的是( )| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 纯铁易被腐蚀,可以在纯铁中混入碳元素制成“生铁”,以提高其抗腐蚀能力 | |
| D. | 光纤通信是现代化的通信手段,光导纤维的主要成分是晶体硅 |
分析 A.油脂是高级脂肪酸跟甘油生成的酯,其中形成油脂的脂肪酸的饱和程度对油脂的熔点有着重要的影响,由饱和的脂肪酸生成的甘油酯熔点较高;
B.蛋白质中含有C、O、H、S、P等;
C.生铁中的Fe、C和电解质溶液易形成原电池,发生电化学腐蚀;
D.光导纤维的主要成分是二氧化硅晶体.
解答 解:A.油脂是高级脂肪酸跟甘油生成的酯,其中形成油脂的脂肪酸的饱和程度对油脂的熔点有着重要的影响,由饱和的脂肪酸生成的甘油酯熔点较高,所以油脂饱和程度越大,熔点越高,故A正确;
B.丝、毛的主要成分是蛋白质,蛋白质中含有C、O、H、S、P等,在燃烧时不仅仅生成二氧化碳和水,故B错误;
C.生铁中的Fe、C和电解质溶液易形成原电池,发生电化学腐蚀,所以生铁比纯铁更易被腐蚀,故C错误;
D.光导纤维的主要成分是二氧化硅晶体,单质硅晶体用作半导体材料,故D错误;
故选:A.
点评 本题考查了物质的性质及用途,明确物质的性质决定其用途是解本题关键,难度不大,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
19.如表是稀硫酸与金属镁反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).
20.一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等.
(1)甲组同学在实验室用如图1所示装置模拟催化法制备和收集一氯甲烷.
①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl=CH3Cl+H2O.如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是Zn(OH)2或ZnO.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定,最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl
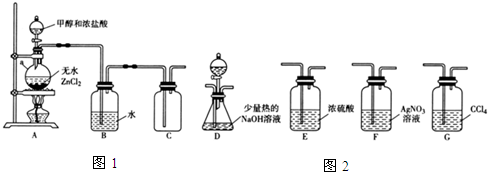
(2)乙组同学选用甲组A、B装置和如图2所示的部分装置检验CH3Cl中的氯元素.(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:CH3ONO2.
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.
③设计实验证明Ksp(AgCl)>Kp(AgBr)向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成浅黄色沉淀,则证明Ksp(AgCl)>Kp(AgBr)(简要说明实验操作、现象和结论)
(1)甲组同学在实验室用如图1所示装置模拟催化法制备和收集一氯甲烷.

①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl=CH3Cl+H2O.如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是Zn(OH)2或ZnO.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定,最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl
(2)乙组同学选用甲组A、B装置和如图2所示的部分装置检验CH3Cl中的氯元素.(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
| 化学键 | C-Cl | C-Br |
| 键能9kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp | 1.8×10-10 | 5×10-13 |
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.
③设计实验证明Ksp(AgCl)>Kp(AgBr)向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成浅黄色沉淀,则证明Ksp(AgCl)>Kp(AgBr)(简要说明实验操作、现象和结论)
17.青蒿酸是合成青蒿素的原料,可以由香草醛合成: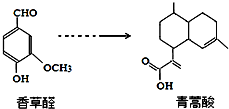 下列叙述正确的是( )
下列叙述正确的是( )
 下列叙述正确的是( )
下列叙述正确的是( )| A. | 青蒿酸分子能在NaOH溶液中发生水解反应 | |
| B. | 在一定条件下,香草醛分子最多有16个原子共面 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 用FeCl3溶液或NaHCO3溶液都可以鉴别香草醛和青蒿酸 |
4.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
14.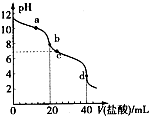 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )| A. | a点:c(CI-)>c(M+)>(OH-)>c(H+) | |
| B. | b点:MOH和HCl恰好完全反应 | |
| C. | c点:c(H+)=c(OH-)+c(MOH) | |
| D. | a点到d点:水电离的c(H+)•c(OH-)先变大,后变小 |
1.已知X、Y、Z、W、R均为短周期元素,且原子序数依次增大.X、W同主族,X与其他元素均不同周期,Y、Z、R三种元素在周期表中的位置如图所示,且Y、Z的单质在常温下为无色气体.下列说法正确的是( )
| Y | Z |
| R |
| A. | R的氧化物对应的水化物一定是强酸 | |
| B. | X、Y、Z三种元素既能形成共价化合物又能形成离子化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10个电子的微粒有2种 | |
| D. | Z、W形成的化合物中只能含有离子键 |
19.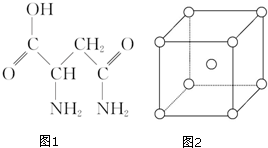 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多,第一电离能最大的是氮.
(2)天冬酰胺中碳原子的杂化轨道类型为sp3和sp2,分子中σ和π键数目之比为8:1.
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
H2S的键角大于H2Se的原因可能为由于硫的电负性强于Se,形成的共用电子对斥力大,键角大.H2O、H2S、H2Se沸点由高到低的顺序为H2O>H2Se>H2S,酸性由强到弱的顺序为H2Se>H2S>H2O.
(4)写出铬的基态电子排布式:1s22s22p63s23p63d54s1或[Ar]3d54s1.
(5)金属铬为体心立方晶体,晶胞结构如图2,则该晶胞中含有2个铬原子.若铬的密度为ρg•
cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm.
 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多,第一电离能最大的是氮.
(2)天冬酰胺中碳原子的杂化轨道类型为sp3和sp2,分子中σ和π键数目之比为8:1.
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
(4)写出铬的基态电子排布式:1s22s22p63s23p63d54s1或[Ar]3d54s1.
(5)金属铬为体心立方晶体,晶胞结构如图2,则该晶胞中含有2个铬原子.若铬的密度为ρg•
cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm.