题目内容
4. (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.| 实验 序号 | 消耗0.1000mol•L-1的 盐酸溶液的体积/mL | 待测氢氧化钠 溶液的体积/mL |
| 1 | 29.02 | 25.00 |
| 2 | 28.01 | 25.00 |
| 3 | 27.99 | 25.00 |
(2)用0.1000mol•L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是0.1120mol•L-1.在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将偏高(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是AC(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
分析 (1)甲基橙、酚酞的变色范围分别是pH在3.1-4.4、8.2-10之间;
(2)据表分析,实验1的数据与实验2实验3差别太大,可忽略,求出实验2和实验3的平均值,再据c(NaOH)=$\frac{c(HCl)•V(HCl)}{V(NaOH)}$求算;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3)A、碱式滴定管量取碱性溶液;
B、盛装待测液的锥形瓶不能使用待测液润洗,否则待测液的物质的量偏大;
C、滴定过程中两眼应注视锥形瓶中溶液颜色的变化,以判断滴定终点;
D、根据量取液体的精确度.
解答 解:(1)甲基橙、酚酞的变色范围分别是pH在3.1-4.4,8.2-10之间,A区pH范围使用的指示剂是酚酞;
故答案为:酚酞;
(2)据表分析,实验1的数据与实验2实验3差别太大,可忽略,实验2和实验3的盐酸溶液的体积平均值V(HCl)=$\frac{28.01mL+27.99mL}{2}$=28.00mL,则c(NaOH)=$\frac{c(HCl)•V(HCl)}{V(NaOH)}$=$\frac{0.1000mol•{L}^{-1}×28.00mL}{25.00mL}$=0.1120mol/L;
在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大;
故答案为:0.1120;偏高;
(3)A、待测的烧碱溶液必须用碱式滴定管量取,故A正确;
B、盛装待测液的锥形瓶不能使用待测液润洗,否则待测液的物质的量偏大,故B错误;
C、滴定过程中两眼应注视锥形瓶中溶液颜色的变化,故C正确;
D、量取待测液需精确到0.01mL,必须用滴定管量取,故D错误;
故答案为:AC.
点评 本题考查了酸碱中和滴定的实验过程,注意指示剂的变色范围,题目难度中等.

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案| A. | CH2═CH2 | B. | CH2═CH-CH═CH2 | ||
| C. |  | D. |  |
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).
| A. | 消耗1 mol CH3CH2OH时转移电子的物质的量为4mol | |
| B. | 1mol/L CH3COOH溶液中含有σ键的数目为7NA个 | |
| C. | H2F+、NH2-、H2S、CH4均与H2O互为等电子体 | |
| D. | 在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键 |
| A. | 0 | B. | 2 | C. | 3 | D. | 8 |
| A. | pH=3的醋酸与pH=11的氢氧化钾 | |
| B. | 0.1 mol/L的盐酸与0.1 mol/L的氨水 | |
| C. | 0.001 mol/L的盐酸与pH=11的氨水 | |
| D. | pH=3的盐酸与0.001 mol/L的氨水 |
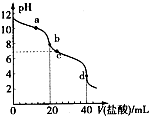 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )| A. | a点:c(CI-)>c(M+)>(OH-)>c(H+) | |
| B. | b点:MOH和HCl恰好完全反应 | |
| C. | c点:c(H+)=c(OH-)+c(MOH) | |
| D. | a点到d点:水电离的c(H+)•c(OH-)先变大,后变小 |