题目内容
11.下列说法正确的是( )| A. | 二氧化硫具有较强的还原性,故不能用浓硫酸干燥 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应 | |
| D. | FeCl3溶液可以腐蚀线路板上的Cu,不能说明Cu的金属活动性大于Fe |
分析 A.二氧化硫与浓硫酸不反应;
B.苯与溴水不反应;
C.苯易取代、难加成、能氧化;
D.Cu与氯化铁反应生成氯化亚铁、氯化铜.
解答 解:A.二氧化硫与浓硫酸不反应,则二氧化硫具有较强的还原性,能用浓硫酸干燥,故A错误;
B.苯与溴水不反应,利用苯、液溴、铁粉混合可制成溴苯,故B错误;
C.苯易取代、难加成、能氧化,则苯的燃烧反应为氧化反应,故C错误;
D.Cu与氯化铁反应生成氯化亚铁、氯化铜,不发生金属单质的置换反应,不能说明Cu的金属活动性大于Fe,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、制备实验、发生的反应等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
19.下列关于苯分子的说法正确的是( )
| A. | 苯分子中有3个C-C键和3个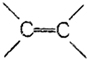 键 键 | |
| B. | 苯分子中的碳碳键是一种介于C-C键和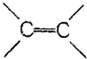 键之间的特殊的键 键之间的特殊的键 | |
| C. | 苯分子中的6个碳碳键不是完全相同的 | |
| D. | 苯分子具有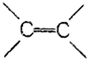 键可以使溴水褪色 键可以使溴水褪色 |
6.W、X、Y、Z均为短周期主族元素,原子序数依次增加,W元素的周期序数、族序数均相等,X、Y、Z的最外层电子数分别为6、2、6.下列说怯正确的是( )
| A. | 原子半径:Z>Y>X>W | |
| B. | Z单质在过量的X单质中燃烧生成ZX3 | |
| C. | 元素Y和W能形成离子化合物 | |
| D. | 元素W、X各自最高和最低化合价的代数和分别为0、4 |
16.下列有机分子中,所有原子不可能处于同一平面的是( )
| A. | CH2═CH2 | B. | CH2═CH-CH═CH2 | ||
| C. |  | D. |  |
19.如表是稀硫酸与金属镁反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).
20.一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等.
(1)甲组同学在实验室用如图1所示装置模拟催化法制备和收集一氯甲烷.
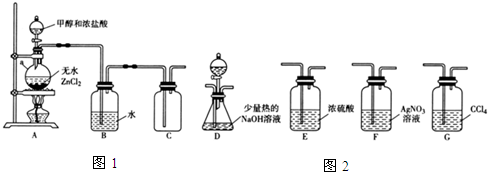
①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl=CH3Cl+H2O.如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是Zn(OH)2或ZnO.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定,最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl
(2)乙组同学选用甲组A、B装置和如图2所示的部分装置检验CH3Cl中的氯元素.(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:CH3ONO2.
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.
③设计实验证明Ksp(AgCl)>Kp(AgBr)向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成浅黄色沉淀,则证明Ksp(AgCl)>Kp(AgBr)(简要说明实验操作、现象和结论)
(1)甲组同学在实验室用如图1所示装置模拟催化法制备和收集一氯甲烷.

①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl=CH3Cl+H2O.如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是Zn(OH)2或ZnO.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定,最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl
(2)乙组同学选用甲组A、B装置和如图2所示的部分装置检验CH3Cl中的氯元素.(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
| 化学键 | C-Cl | C-Br |
| 键能9kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp | 1.8×10-10 | 5×10-13 |
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.
③设计实验证明Ksp(AgCl)>Kp(AgBr)向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成浅黄色沉淀,则证明Ksp(AgCl)>Kp(AgBr)(简要说明实验操作、现象和结论)

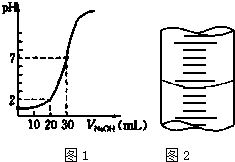 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题: