题目内容
10.聚芳酯(PAR)在航空航天等领域具有广泛应用.如图是合成某聚芳酯的路线: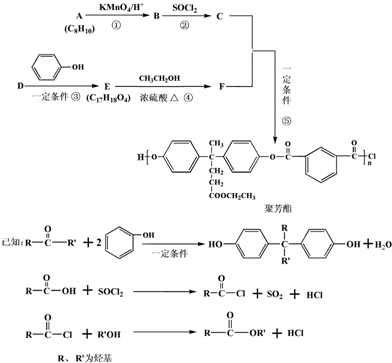
(1)A的结构简式为
 .
.(2)B中含有的官能团名称是羧基.
(3)反应⑤的反应类型是缩聚.
(4)D→E的化学方程式为
 .
.(5)下列关于F描述正确的是ad.
a.能与FeCl3发生显色反应 b.与浓溴水、NaHCO3溶液都能发生反应
c.能发生取代、加成、消去反应 d.1mol F最多能与3mol NaOH反应
(6)M是符合下列条件的B的同分异构体
a.能发生银镜反应、水解反应,还能与Na2CO3溶液反应
b.苯环上只有两个取代基且无“-O-O-”结构
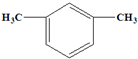
M共有12种;其中存在着含4种不同化学环境的氢的物质,写出其与Na2CO3溶液反应但不产生气体的化学方程式(任写一种)
 或
或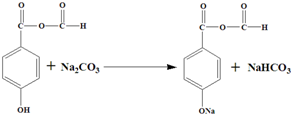 .
.
分析 由聚芳香酯结构简式知结合A的分子式知,反应⑤为缩聚反应,F为 ,C为
,C为 ,根据转化关系,A发生氧化反应生成B,B发生信息中的取代反应生成C,所以A为
,根据转化关系,A发生氧化反应生成B,B发生信息中的取代反应生成C,所以A为 ,B为
,B为 ,根据E的分子式结合F的结构简式可知,D发生信息中的反应生成 E,为酚羟基的对位加成,E发生酯化反应生成 F,所以D为CH3COCH2CH2COOH,E为
,根据E的分子式结合F的结构简式可知,D发生信息中的反应生成 E,为酚羟基的对位加成,E发生酯化反应生成 F,所以D为CH3COCH2CH2COOH,E为 ,反应①为氧化反应,且则A为
,反应①为氧化反应,且则A为 ,反应②为酯化反应,则B为
,反应②为酯化反应,则B为 ,结合有机物的结构与性质来解答.
,结合有机物的结构与性质来解答.
解答 解:由聚芳香酯结构简式知结合A的分子式知,反应⑤为缩聚反应,F为 ,C为
,C为 ,根据转化关系,A发生氧化反应生成B,B发生信息中的取代反应生成C,所以A为
,根据转化关系,A发生氧化反应生成B,B发生信息中的取代反应生成C,所以A为 ,B为
,B为 ,根据E的分子式结合F的结构简式可知,D发生信息中的反应生成 E,为酚羟基的对位加成,E发生酯化反应生成 F,所以D为CH3COCH2CH2COOH,E为
,根据E的分子式结合F的结构简式可知,D发生信息中的反应生成 E,为酚羟基的对位加成,E发生酯化反应生成 F,所以D为CH3COCH2CH2COOH,E为 ,反应①为氧化反应,且则A为
,反应①为氧化反应,且则A为 ,反应②为酯化反应,则B为
,反应②为酯化反应,则B为 ,
,
(1)根据上面的分析可知,A的结构简式为 ,
,
故答案为: ;
;
(2)B为 ,B中含有的官能团名称是羧基,
,B中含有的官能团名称是羧基,
故答案为:羧基;
(3)根据上面的分析可知,反应⑤的反应类型是 缩聚,
故答案为:缩聚;
(4)D发生信息中的对位加成反应生成 E,反应的化学方程式为  ,
,
故答案为: ;
;
(5)F为 ,
,
a.F中含有酚羟基,所以能与FeCl3发生显色反应,故a正确;
b.F中没有羧基,所以不能一NaHCO3溶液发生反应,故b错误;
c.F不能发生消去反应,故c错误;
d.根据F的结构简式可知,1mol F最多能与3mol NaOH反应,故d正确;
故选ad;
(6)B为 ,根据条件a.能发生银镜反应、水解反应,说明有醛基和酯基,或甲酸某酯,还能与Na2CO3溶液反应,说明有羧基或酚羟基,b.苯环上只有两个取代基且无“-O-O-”结构,则符合 条件的M的结构为
,根据条件a.能发生银镜反应、水解反应,说明有醛基和酯基,或甲酸某酯,还能与Na2CO3溶液反应,说明有羧基或酚羟基,b.苯环上只有两个取代基且无“-O-O-”结构,则符合 条件的M的结构为 ,共有 12种;其中存在着含4种不同化学环境的氢的物质与Na2CO3溶液反应但不产生气体的化学方程式为
,共有 12种;其中存在着含4种不同化学环境的氢的物质与Na2CO3溶液反应但不产生气体的化学方程式为 或
或 ,
,
故答案为:12; 或
或 .
.
点评 本题考查有机物推断,为高考高频点,侧重考查学生分析推断能力,根据反应物、聚芳酯结构简式结合反应条件、物质分子式进行推断,难点是同分异构体种类判断,题目难度中等.

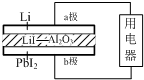 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )| A. | 电子由b极经用电器流向a极 | |
| B. | I-由a极通过固体电解质传递到b极 | |
| C. | b极上的电极反应式为:PbI2-2e-=Pb+2I- | |
| D. | b极质量减少1.27 g 时,a极转移的电子数约为6.02×1021 |
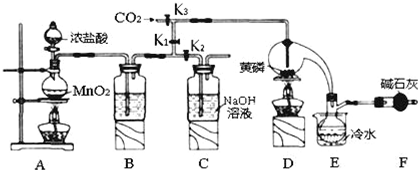
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生 成 H3PO3和HC1;③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)F中碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
| A. | 苯分子中有3个C-C键和3个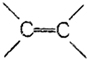 键 键 | |
| B. | 苯分子中的碳碳键是一种介于C-C键和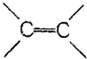 键之间的特殊的键 键之间的特殊的键 | |
| C. | 苯分子中的6个碳碳键不是完全相同的 | |
| D. | 苯分子具有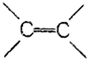 键可以使溴水褪色 键可以使溴水褪色 |
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).