题目内容
11. 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用.铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O.
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为Cu,当线路中转移0.2mol电子时,则被腐蚀铜的质量为6.4g
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为B.
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
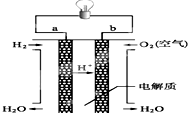
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
①氢氧燃料电池的总反应化学式是:2H2+O2=2H2O.
②电池工作一段时间后电解质溶液的pH增大(填“增大”、“减小”或“不变”).
分析 (1)蓄电池在放电时正极上PbO2得电子,负极上Pb失电子,据此书写总反应;
(2)该电池反应中,铜失电子发生氧化反应,作负极;根据电极方程式计算;
(3)原电池中失电子的一极为负极;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水;
②根据燃料电池的总反应方程式判断硫酸浓度、pH的变化.
解答 解:(1)放电时,正极上PbO2得电子,正极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,负极上Pb失电子,Pb+SO42--2e-═PbSO4,总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,
故答案为:Pb+PbO2+2H2SO4=2PbSO4+2H2O;
(2)该电池反应中,铜失电子发生氧化反应,作负极;负极反应式为Cu-2e-=Cu2+,则当线路中转移0.2mol电子时,反应的Cu为0.1mol,其质量为6.4g;
故答案为:Cu;6.4;
(3)铝片和铜片插入浓HNO3溶液中,金属铝会钝化,金属铜和浓硝酸之间会发生自发的氧化还原反应,此时金属铜时负极,金属铝是正极;
插入稀NaOH溶液中,金属铜和它不反应,金属铝能和氢氧化钠发生自发的氧化还原反应,此时金属铝是负极,金属铜是正极;
故答案为:B;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水,其反应的总方程式为:2H2+O2=2H2O,
故答案为:2H2+O2=2H2O;
②已知氢氧燃料电池的总反应为:2H2+O2=2H2O,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小,pH增大;
故答案为:增大.
点评 本题考查了原电池原理的应用,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

 名校课堂系列答案
名校课堂系列答案| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,能表明这一规律的分别是实验6和实验7或实验8和实验9;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验5(填实验序号),该实验中硫酸平均反应速率为0.004mol/(L•s).
| A. | 0 | B. | 2 | C. | 3 | D. | 8 |
| A. | HCl | B. | NH3•H2O | C. | H2SO3 | D. | HClO |
(1)甲组同学在实验室用如图1所示装置模拟催化法制备和收集一氯甲烷.
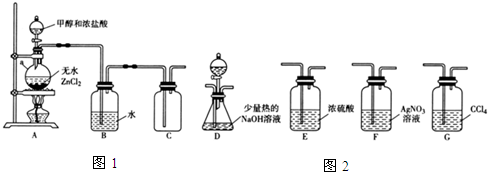
①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl=CH3Cl+H2O.如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是Zn(OH)2或ZnO.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定,最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl
(2)乙组同学选用甲组A、B装置和如图2所示的部分装置检验CH3Cl中的氯元素.(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
| 化学键 | C-Cl | C-Br |
| 键能9kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp | 1.8×10-10 | 5×10-13 |
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.
③设计实验证明Ksp(AgCl)>Kp(AgBr)向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成浅黄色沉淀,则证明Ksp(AgCl)>Kp(AgBr)(简要说明实验操作、现象和结论)
| Y | Z |
| R |
| A. | R的氧化物对应的水化物一定是强酸 | |
| B. | X、Y、Z三种元素既能形成共价化合物又能形成离子化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10个电子的微粒有2种 | |
| D. | Z、W形成的化合物中只能含有离子键 |

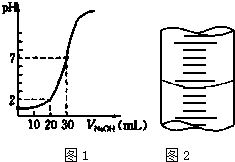 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题: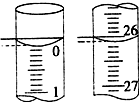 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白: