题目内容
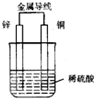 如图是铜锌原电池,某同学做完实验后记录如下:
如图是铜锌原电池,某同学做完实验后记录如下:①Zn为正极,Cu为负极
②电解质溶液pH不变
③电子流动的方向为:Zn→Cu
④Cu极上有氢气产生
⑤若有1mol电子流过导线,则产生氢气0.5mol
⑥该原电池产生氢气的速度比没有导线相连时慢
上述记录中描述正确的是
考点:原电池和电解池的工作原理
专题:
分析:Zn-Cu原电池中,Zn作负极,发生电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阳离子向正极移动,以此来解答.
解答:
解:①Zn为负极,Cu为正极,故①错误;
②Cu电极上发生2H++2e-=H2↑,消耗氢离子,pH增大,故②错误;
③电子由负极流向正极,即由Zn电极流向Cu电极,故③正确;
④Cu电极上发生2H++2e-=H2↑,故④正确;
⑤由2H++2e-=H2↑可知,有1mol电子流向导线,产生氢气0.5mol,故⑤正确;
⑥发生原电池反应较一般化学反应快,故⑥错误.
故答案为:③④⑤.
②Cu电极上发生2H++2e-=H2↑,消耗氢离子,pH增大,故②错误;
③电子由负极流向正极,即由Zn电极流向Cu电极,故③正确;
④Cu电极上发生2H++2e-=H2↑,故④正确;
⑤由2H++2e-=H2↑可知,有1mol电子流向导线,产生氢气0.5mol,故⑤正确;
⑥发生原电池反应较一般化学反应快,故⑥错误.
故答案为:③④⑤.
点评:本题考查了原电池原理,根据原电池上发生的反应类型、电流的流向等知识来分析解答即可,注意溶液中阴阳离子的移动方向,为易错点.

练习册系列答案
相关题目
已知氯化银在水中存在沉淀溶解平衡:AgCl?Ag++Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
| A、100mL蒸馏水中 |
| B、50mL0.1mol?L-1的氯化镁溶液 |
| C、150mL0.1mol?L-1的氯化钠溶液 |
| D、50mL0.1mol?L-1的氯化铝溶液 |
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
下列物质属于含有共价键的离子化合物的是( )
| A、MgCl2 |
| B、Br2 |
| C、KOH |
| D、H2S |
弱电解质电离要吸收热量.分别用40克氢氧化钠和盐酸、醋酸完全反应,放出的热量( )
| A、前者大于后者 | B、相等 |
| C、前者小于后者 | D、无法判断 |
下列关于胶体的认识错误的是( )
| A、将含0.1mol/L的氯化铁饱和溶液滴入沸水中形成的胶体粒子数目小于0.1NA |
| B、纳米材料微粒直径一般从几纳米到几十纳米.因此纳米材料属于胶体 |
| C、往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解 |
| D、水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.