题目内容
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.37%,乙中c电极质量增加.据此回答问题:
①电源的N端为
②电极b上发生的电极反应为
③电解前后丙溶液 pH
(2)写出乙溶液中的电解反应的离子方程式:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明C电极是电解池阴极,则d电极是阳极,连接电解池阳极的原电池电极是正极;
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气;
③电解丙溶液时,根据阴阳极上析出的物质确定溶液中氢离子浓度是否变化来判断溶液的pH值是否变化;
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气;
③电解丙溶液时,根据阴阳极上析出的物质确定溶液中氢离子浓度是否变化来判断溶液的pH值是否变化;
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气.
解答:
解:(1)①该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明C电极是电解池阴极,则d电极是阳极,连接电解池阳极的原电池电极是正极,所以N是原电池正极,故答案为:正;
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
③电解K2SO4溶液时,阴极上析出氢气,阳极上析出氧气,实际上电解的是水,K2SO4溶液的浓度增大,但溶液的pH值不变,故答案为:不变;
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气,2Cu2++2H2O
2Cu+O2↑+4H+,故答案为:2Cu2++2H2O
2Cu+O2↑+4H+.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
③电解K2SO4溶液时,阴极上析出氢气,阳极上析出氧气,实际上电解的是水,K2SO4溶液的浓度增大,但溶液的pH值不变,故答案为:不变;
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气,2Cu2++2H2O
| ||
| ||
点评:本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
下列判断正确的是( )
| A、在水电离出来的c(H+)=1×10-13mol/L的溶液中Fe3+、NH4+、NO3-一定不能大量共存 |
| B、AlCl3溶液蒸干后得到的固体是AlCl3 |
| C、在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7 |
体积相同的甲、乙两个容器,分别都充等量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)?2SO3(g) 并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为( )
| A、大于a% | B、等于a% |
| C、小于a% | D、无法判断 |
随着矿石能源的紧缺,电动汽车将成为汽车市场的主角.电动汽车以LiFePO4电池作为动力,LiFePO4电池具有稳定性高、安全、对环境友好等优点.电池反应为:LiFePO4
FePO4+Li,负极材料是石墨,电解质为含Li+的导电固体.下列有关LiFePO4电池说法正确的是( )
| 充电 |
| 放电 |
| A、放电时电池内部Li+向负极移动 |
| B、电池的负材料为Li |
| C、放电过程中,电池正极材料发生氧化反应 |
| D、充电时阴极反应为:FePO4+Li++e-═LiFePO4 |
如图为原电池示意图,下列说法中正确的是( )


| A、锌片是正极 |
| B、铜片是负极 |
| C、电子由锌片通过导线流向铜片 |
| D、该装置能够将电能转化为化学能 |
阿伏加德罗常数用NA表示,下列叙述正确的是( )
| A、常温常压下,1 mol NO2中含有的分子数为 NA |
| B、常温常压下,0.2mol铁在0.2 mol氯气中充分燃烧,转移的电子数为 0.6NA |
| C、7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
| D、11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数为0.5NA |
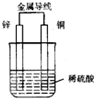 如图是铜锌原电池,某同学做完实验后记录如下:
如图是铜锌原电池,某同学做完实验后记录如下: