题目内容
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
考点:氧化还原反应的计算
专题:
分析:NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应过程中,氯元素化合价降低,硫元素化合价升高,结合电子守恒计算.
解答:
解:NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应过程中,氯元素化合价有+5价降到+4价,降低了1价,硫元素化合价从+4价升高到+6价,升高了2价,由电子守恒可知,NaClO3和Na2SO3的物质的量之比为
=2:1,
故选B.
| (6-4) |
| (5-4) |
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列关于镁及其化合物的叙述不正确的是( )
| A、把镁粉投入氯化铁溶液中,常温下不会有氢气放出 |
| B、工业上通常用煅烧菱镁矿来制取氧化镁 |
| C、镁的主要用途是用于制造合金和照明弹 |
| D、食盐中如含氯化镁就易潮解 |
下列判断正确的是( )
| A、在水电离出来的c(H+)=1×10-13mol/L的溶液中Fe3+、NH4+、NO3-一定不能大量共存 |
| B、AlCl3溶液蒸干后得到的固体是AlCl3 |
| C、在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7 |
体积相同的甲、乙两个容器,分别都充等量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)?2SO3(g) 并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为( )
| A、大于a% | B、等于a% |
| C、小于a% | D、无法判断 |
随着矿石能源的紧缺,电动汽车将成为汽车市场的主角.电动汽车以LiFePO4电池作为动力,LiFePO4电池具有稳定性高、安全、对环境友好等优点.电池反应为:LiFePO4
FePO4+Li,负极材料是石墨,电解质为含Li+的导电固体.下列有关LiFePO4电池说法正确的是( )
| 充电 |
| 放电 |
| A、放电时电池内部Li+向负极移动 |
| B、电池的负材料为Li |
| C、放电过程中,电池正极材料发生氧化反应 |
| D、充电时阴极反应为:FePO4+Li++e-═LiFePO4 |
下列反应的离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
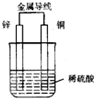 如图是铜锌原电池,某同学做完实验后记录如下:
如图是铜锌原电池,某同学做完实验后记录如下: