题目内容
设NA 为阿伏加德罗常数的值.下列说法正确的数量为( )
①1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA
②78g 苯含有C=C 双键的数目为3NA
③常温常压下,14g 由N2与CO组成的混合气体含有的原子数目为NA
④标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
⑤常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA
⑥1mol甲醇中含有C-H键的数目为4NA
⑦25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
⑧标准状况下,2.24L已烷含有分子的数目为0.1NA
⑨常温常压下,18g H2O 中含有的原子总数为3NA
⑩标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA.
①1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA
②78g 苯含有C=C 双键的数目为3NA
③常温常压下,14g 由N2与CO组成的混合气体含有的原子数目为NA
④标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
⑤常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA
⑥1mol甲醇中含有C-H键的数目为4NA
⑦25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
⑧标准状况下,2.24L已烷含有分子的数目为0.1NA
⑨常温常压下,18g H2O 中含有的原子总数为3NA
⑩标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA.
| A、1个 | B、2个 | C、3个 | D、4个 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:①ClO-是弱酸根,在水溶液中会水解;
②根据苯的结构来分析;
③根据N2与CO的摩尔质量均为28g/mol和两者均为双原子分子来分析;
④根据NO2与水的反应为歧化反应来分析;
⑤Na2O2与H2O的反应是歧化反应;
⑥依据甲醇结构分析化学键数目;
⑦溶液体积不明确;
⑧标况下,己烷为液态;
⑨根据H2O是三原子分子来分析;
⑩氯气与水的反应为可逆反应,不能进行彻底;
②根据苯的结构来分析;
③根据N2与CO的摩尔质量均为28g/mol和两者均为双原子分子来分析;
④根据NO2与水的反应为歧化反应来分析;
⑤Na2O2与H2O的反应是歧化反应;
⑥依据甲醇结构分析化学键数目;
⑦溶液体积不明确;
⑧标况下,己烷为液态;
⑨根据H2O是三原子分子来分析;
⑩氯气与水的反应为可逆反应,不能进行彻底;
解答:
解:①ClO-是弱酸根,在水溶液中会水解,故溶液中ClO-的个数小于NA,故①错误;
②苯不是单双键交替的结构,苯的结构中无双键,故②错误;
③N2与CO的摩尔质量均为28g/mol,故14g混合气体的物质的量n=
=0.5mol,而两者均为双原子分子,故0.5mol混合气体含有1mol原子,故③正确;
④标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故④错误;
⑤Na2O2与H2O的反应是歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应转移2mol电子,生成1molO2,故当生成0.2molO2,转移电子0.4mol,数目为0.4NA,故⑤正确;
⑥甲醇结构简式CH3OH,1mol甲醇中含有C-H键的数目为3NA,故错误;
⑦溶液体积不明确,无法计算氢氧根的个数,故⑦错误;
⑧标况下,己烷为液态,故错误;
⑨18gH2O 的物质的量为1mol,而H2O 是三原子分子,故1mol水中含3mol原子,故⑨正确;
⑩氯气与水的反应为可逆反应,不能进行彻底,故0.1mol Cl2溶于水,转移的电子数目小于0.1NA.故错误;
故选C.
②苯不是单双键交替的结构,苯的结构中无双键,故②错误;
③N2与CO的摩尔质量均为28g/mol,故14g混合气体的物质的量n=
| 14g |
| 28g/mol |
④标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故④错误;
⑤Na2O2与H2O的反应是歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应转移2mol电子,生成1molO2,故当生成0.2molO2,转移电子0.4mol,数目为0.4NA,故⑤正确;
⑥甲醇结构简式CH3OH,1mol甲醇中含有C-H键的数目为3NA,故错误;
⑦溶液体积不明确,无法计算氢氧根的个数,故⑦错误;
⑧标况下,己烷为液态,故错误;
⑨18gH2O 的物质的量为1mol,而H2O 是三原子分子,故1mol水中含3mol原子,故⑨正确;
⑩氯气与水的反应为可逆反应,不能进行彻底,故0.1mol Cl2溶于水,转移的电子数目小于0.1NA.故错误;
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列判断正确的是( )
| A、在水电离出来的c(H+)=1×10-13mol/L的溶液中Fe3+、NH4+、NO3-一定不能大量共存 |
| B、AlCl3溶液蒸干后得到的固体是AlCl3 |
| C、在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7 |
阿伏加德罗常数用NA表示,下列叙述正确的是( )
| A、常温常压下,1 mol NO2中含有的分子数为 NA |
| B、常温常压下,0.2mol铁在0.2 mol氯气中充分燃烧,转移的电子数为 0.6NA |
| C、7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
| D、11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数为0.5NA |
下列离子方程式正确的是( )
| A、碳酸钙和盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ |
| C、向稀盐酸溶液中加铁:3Fe+6H+═3Fe3++3H2↑ |
| D、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-═BaSO4↓ |
下列反应的离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
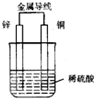 如图是铜锌原电池,某同学做完实验后记录如下:
如图是铜锌原电池,某同学做完实验后记录如下: